医薬品の安全性評価は、企業におけるリアルワールドデータ(RWD)利活用の花形です。
とはいえ医薬品の安全性評価におけるRWD利活用は2018年に解禁されたばかりで、どの企業も「ど、どうすれば」状態。
そんな中で、PMDAや製薬協はデータベース研究のガイドラインを整備してきました。
PMDAガイドライン一覧:https://www.pmda.go.jp/safety/surveillance-analysis/0046.html
製薬協ガイドライン:https://www.jpma.or.jp/information/evaluation/results/allotment/PV_202401_PMSDBGB.html
それぞれ鬼素晴らしいので必読です。
そんな中、ICHが新たに国際ガイドラインを発出しましたので、勝手に解説していきたいと思います。
ちなみにICHはInternational Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use(医薬品規制調和国際会議)の略称で、医薬品規制当局と製薬業界の代表者が協働して、医薬品規制に関するガイドラインを科学的・技術的な観点から作成する国際会議です。
要は世界中の企業と行政の代表者が集って、「国際的ガイドライン作って世界の標準を作ろうぜ」っていう会議体ですね。
これまでも様々なガイドラインを作成してきており、その一覧はこちら。
そこに今回新たに加わったのがICH-M14「安全性評価においてRWDを活用する薬剤疫学調査の計画・デザインに関する一般原則」です(以下、本ガイドライン)。
英語だと「General Principles on Plan, Design and Analysis of Pharmacoepidemiological Studies That Utilize Real-World Data for Safety Assessment of Medicines」ですね。
英語で49ページもあるので「読むのたるいわ」って感じだと思いますが、企業の疫学専門家として「ここ要チェック」なポイントだけを抜き出して解説していきます。網羅的に解説するわけでなく「ここええやん」と思ったとこだけの抜き出しなのでご容赦ください。

「RWD研究の支援をしてほしい」というご相談を多くの企業様から頂戴するので、企業様向けに正式に窓口を設置しました。
以下のアドレスに連絡頂ければ私に直通しますので、「1時間の無料相談」も含めてお気軽にご連絡ください(3営業日以内にお返事させて頂きます)。無料相談は大変ご盛況となっており、先着順にて対応させて頂いております。
お問合せ先:naoki.hirose@mmedici.co.jp(廣瀬個人アドレス)
私が経営するmMEDICI株式会社ではRWD利活用支援を事業の柱の一つとしており、以下の強みを有しています。「企業の」RWD研究においては日本トップクラスの解像度と経験値を有する自信がありますので、ぜひ無料相談でご体験くださいませ。
- 元大手外資の日本・グローバル出身の疫学専門家が全案件を担当するので、「企業の」RWD研究に高い解像度を有しています
- ただ成果物を納品するだけでなく、グローバルやKOLとの合意形成、社内プレゼン、規制当局対応などRWD研究の「プロセス」も全てまきとれます
- 企業のRWD研究を幾度となく経験しており、企画立案から論文化までの全フェーズを一気通貫で対応できます
- アカデミアのRWD研究者と広い繋がりを有しており、必要に応じた専門人材のアサインが可能です
- RWD研究だけでなく、事業立案、マーケ、広報、営業などのRWDビジネスも全て対応可能です
以下に私の実績を記載させて頂きます。
- 大手外資製薬2社にて、部門唯一の疫学専門家として活動をリード
- 「RWDビジネスの教科書」の書籍を出版(サイドバーをご覧ください)
- 企業でのRWD研究の経験は50本以上
- 製造販売後データベース調査のリード経験多数
- これまで製薬、CRO、コンサル、総合商社、ヘルステックなど10社以上の企業のRWD研究・RWDビジネスを支援
- 50組織以上にRWD研修を提供
- 全体統括・講師を勤めたJapan RWD Summitでは初回から約1,700名の集客を実現
無料相談では、以下のような内容を含め企業様の「RWD」と名のつく相談でしたら全て対応させて頂きます。
- このテーマでRWD研究はできるの?
- RWD研究っていくらくらいかかるの?
- RWD研究ってどんなプロセスでやれば良いの?
- 製造販売後データベース調査のやり方を教えてほしい
- RWD研究をするにはどんな専門家を雇えば良いの?
- 自社のRWDサービスを売りたいんだけど、強みはどこ?集客はどうすれば良い?
無料相談は先着順での対応となりますので、ご希望の企業様はぜひお早めのコンタクトをお願い致します!
お問合せ先:naoki.hirose@mmedici.co.jp(廣瀬個人アドレス)
本ガイドラインのスコープ
以下の研究は安全性に関するものであってもスコープ外です。
- 自発報告を使った研究
- 介入研究
- 患者報告データを使った研究
RWDでエビデンスを創出するステップ
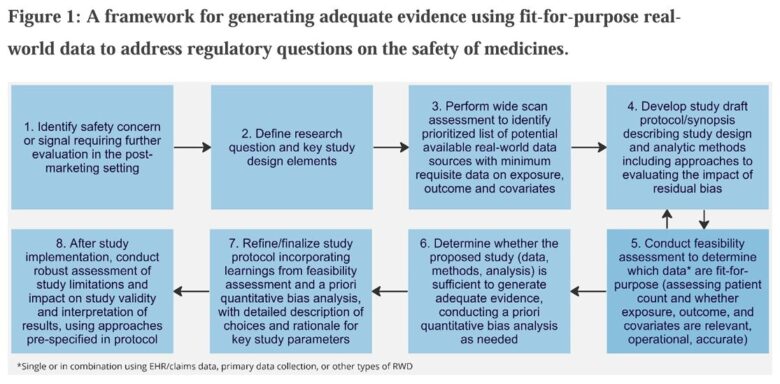
本ガイドラインより引用
一般的なRWD研究のフローですが、ステップ4に”evaluating the impact of residual bias”が、ステップ6に”conducting a priori quantititive bias analyses”があることが特徴的です。RWD研究は温室栽培された美しいデータではなく、野生の乱雑なデータを使いますから、まず「このRWDでほんとにやりたいことができるんか?」ということを丁寧に確認しなければなりません。
そこらへんのFeasibility Checkについてはこちらから始まる3本の記事で解説しています。
こんにちは、すきとほる疫学徒です。 製薬企業で疫学研究をしておりますと、色々なところでデータベース事業者さんからお声をかけて頂くことがあるのですが、ここ数年でデータベース事業者さんや、事業者さんが扱う医療大規模データベース[…]
Research Questionについて
Research Questionは「それを読めば研究デザインがありありと想像できる」ように網羅的・粒度鮮明に書かねばなりません。企業の方ですと研究者でなくともRWD研究に携わることはしばしばあると思いますが、Research Questionがうまく書けていないことが多いですね。
本ガイドラインで説明されている通り、Research Questionは以下を含めるように書いてやると綺麗にかけます。
- Population
- Exposure
- Comparator
- Outcome
- Timing
また、本ガイドラインの指摘で重要なのは「The specific question should be formulated after a review of the literature to 131 identify and understand any knowledge gaps, strengths and weaknesses of prior studies, the 132 expected magnitude of effect, and important confounding factors」という記述ですね。
要は「ちゃんといろんなこと調査してからResearch Question書けや」ということ。企業の方だと、①まずResearch Questionを作り、②次に調査する、というようにResearch Questionを「自分のやりたい研究目的を素朴に書く」ものだと誤解している方が非常に多いです。
違うのです、Research Questionはは作品であり、それを書く時点ではすでに研究の実現可能性も含めた全体像が頭のなかに描けていなくてはなりません。Research Questionから始まるのではなく、ぼんやりとでもこねくりあげた研究デザインをResearch Questionに凝縮させるというイメージです。
「じゃあその研究デザインは何をベースに作ればいいんじゃないか?Research Questionじゃないのか?」と言われると「そうです」なので、「やっぱResearch Questionから始まってんじゃん」って思うかもしれないですが、私の場合はReserach Questionと研究デザインを行ったり来たりしながら調整していくということをしています。
臨床経験と医療データベースの知識を持ちながら何度もRWD研究をやっているとResearch Questionを作った段階で「これに実現可能性持たせるならこんなデザインだな」とパッと想像することができるようになるので、その想像で壁打ちするようにしてResearch Questionを錬磨していく感じといいましょうか。
「それができないから困ってんだ」という声が聞こえてきそうですが、その場合はやはりResearch Questionを作って、研究デザインにして、「やっぱこれ無理だわ」を何度も繰り返すしかないですね。
あと、このパートで大切なのは「フレームワーク、たとえばTarget TrialとかEstimand使うと良い感じにデザイン組めるぜ」ってこと。日本のRWD研究だとまだまだ認知されてないフレームワークですが、今後使用が必須になっていくと思うのでキャッチアップしておきましょう。
調べるとガイドラインとかブログとか沢山でてきます。
Feasibility Checkについて
RWD研究をするためには「このデータでResearch Questionにアドレスできるんか?」というFeasibility Checkをせねばなりません。
ちなみにこのFeasibility Check、理論的にはResearch Questionの設定後に位置付けられますが、上述の通り私は双方を行き来します。まずResearch Questionがあり、脳内Feasibility Checkをして、「ここアカンは」と思えば科学的妥当性を失わない範囲でResearch Questionを修正して、そんでまた脳内Feasibility Checkをして、それで「いけるっぽいな」と思った段階で本格的にFeasibility Checkをします。
要点は、
Research Question→Feasibility Check→できない、で終わりにせず、もし科学的妥当性を失わずにResearch Questionを修正できるなら、FeasibileなStudyをするために譲歩すべきだよとうことです。そこで譲歩しなければ一生RWD研究なんてできませんから。ただ、あくまでも「科学的妥当性を失わない範囲で」ですよ。
「Feasibility Checkで何を見れば良いのか?」ということは本ガイドラインをお読みください。ちなみに企業で行われるRWD研究のFeasibilty Checkは鬼ユルなので、初期からRWD研究の専門家を入れてしっかりとやっていきましょう。
たとえばアウトカムに対するFeasibility Checkだと、「病名に該当するICD-10コードがあるからOK」ではなく、「そのコードがどんな時にふられるのか」、「検査や処方、処置と組み合わせてより良いアウトカム定義が作れそうか」、「先行研究でアウトカムのアルゴリズムの妥当性は検証されていないか」まで確認して初めてFeasibileかどうかが判断できます。
Study Design
Researchers should also consider developing graphical representations (such as a study design diagram) to clarify the analysis plan and time components such as inclusion period, lookback period, follow-up period, overall study period.
「Graphical representationってなんやねん?」って感じだと思いますが、要は「デザインダイアグラムを描け」ということです。
ここで描き方を解説しましたが、デザインダイアグラムは必須だと思って、皆さんRWD研究をする際には必ず描きましょう。
こんな人におすすめの記事です。 観察研究のデザインが複雑すぎてうまく文章にできない 文章にできたけど、読者にきちんと伝えられてるか不安 こんなお悩みを解決します。 『Real World Da[…]
Target/Study Population
Target PopulationとStudy Populationの違いって分かりますか?
Target Population:その研究で明らかにしたい集団
Study Population:その研究で明らかにできる集団
RWDの場合、この二つが一致することはほぼなく、「見たい集団と、実際に見れている集団」のギャップが存在します。ですので、Study Populationは一体何なのか、そしてギャップは許容範囲なのかということを考えねばなりません。
Exposure, Outcomes, Covariates
曝露、アウトカム、共変量はConceptual definitionとOperational definitionに分けて定義します。
たとえば肺炎をアウトカムにするならば、Conceptual definitionは肺炎であり、Operational definitionは「ICD-10の〜が振られていて、そのX日以内に治療薬Aが投与されている患者」などですね。
これはFeasibility Checkの段階で定義しておかねばならず、曖昧に「肺炎をみよう〜」とConcenptual definitionだけしか考えずに研究を進めると、「Operational definitionが作れない」と途中で崩壊します。
なお、Operational definitionを記載する際にはlimitaionを書くことが大切です(RWDはlimitationの科学)。たとえば、そのOperational definitionを使うとどのくらいの誤分類が起こるか、そしてそのlimitationはStudy Designの工夫でどれだけアドレスできるかなど。
また、大切な点は「データソースが変わればOperational definitionの妥当性も変わる」ということです。アメリカのデータで作った肺炎定義は日本のそれには直接外挿できない可能性が高いですし、同じ日本でも大学病院のそれとクリニックのそれ、高齢者のそれと小児のそれは全く異なります。ですから、「先行研究でこの定義があるからこれ使おう」ではなく、その先行研究と自身の研究でどれだけ環境が違うかを考えた上で定義を外挿しなけれればなりません。
本ガイドラインはどうOperational definitionを作成するか丁寧に解説されていますので、ご覧になってください。素晴らしいことに、Exposure, Outcomes, Covariatesのそれぞれに対してConceptual definitionとOperational definitionの作り方を解説しています。Exposureあたりは驚くほど細かいので、心折られながら読んでみてください(これくらい考えないとまともなRWD研究とかできないの…)。まじで細かくて心折れると思いますが、そういうもんです。私もかれこれ30本くらいRWD研究のプロトコールを製薬で作ってきましたが、いまだに曝露の定義を考える際には「まじでめんどくさい、2度とやりたくない」と思いながらやってます。
ちなみにOutcome, Covariateのパートも読み応えがありますが、特に言及したいのはCovariateのパートのEffect Modificationですね。Covariateを取得する目的としてはおそらく交絡もしくは患者背景が人々の脳内を占めていますが、Effect Modificationもしっかり意識せねばなりません。Effect Modificationが何かについてはこの記事の本筋ではないので記載しませんが、ぜひ学んでおくと良いでしょう。
Bias and Confounding
特に企業人が注目すべき記載は以下ですね。
Therefore, the handling of missing data should also be prespecified in the Data Management section (see Section 6, Data Management) or Analysis section (see Section 7.1, Statistical Analysis) of the protocol.
欠損の扱いは研究計画書中で明示されねばなりません。欠損がある患者を除外してComplete case analysesをするのか、多重代入法などでimputationして解析するのか。欠損の扱いによってStudy populationが変わり、また選択バイアスの影響も変わります。しかしながら、企業の研究計画書では欠損の扱いを明示していないものが多く、なのであえて気をつけましょうと言ってみました。
Biasには大きく分けて3種、交絡バイアス、測定バイアス、選択バイアスとあり、おそらく企業人の頭に最初に浮かぶのは交絡バイアスでしょう。
他のバイアスは軽視されていることが非常に多いのが日本の企業の実情です。本ガイドラインにも記載がありますが、たとえば企業の薬剤疫学研究で頻発する選択バイアスにPrevalent user biasがありますが、正しくアドレスしている研究計画書は稀です。気をつけましょう。詳細を知りたい方はこちらからどうぞ。
こんにちは、すきとほる疫学徒です。 本日は、薬剤疫学分野で観察研究を行う際に注意しなければならないバイアス、Prevalent user biasを取り上げ、その理論的背景、具体例、そして対処法について解説していきたいと思[…]
測定バイアスについて印象深かった記述は以下。
Whereas internal validity should always be optimized, and misclassification of key variables should be minimized to accurately estimate the effect of exposure on the outcome, some degree of misclassification may be acceptable in some studies depending on the study question and regulatory purpose and should be determined on a case-by-case basis. Overall, the extent of variable validation (see Validation) should be determined by the necessary level of certainty and the implication of potential misclassification on study inference.
要は「変数の妥当性は大切だけど、どこまで妥当性を求めるかはケースバイケースでいこうや」というまぁ寛容なお達しです。「すべてのアウトカムに対して妥当性を検証しないといけない!」と血気盛んに叫ぶ方がいれば、そっとこの記述を提供してあげましょう。その「妥当性を検証する」ための手段がValidation studyであり、その解説も本ガイドラインで行われています。Validation studyに関してはこちらからどうぞ。
こんにちは、すきとほる疫学徒です。 このシリーズでは、アウトカムの誤測定がもたらす影響、誤測定を減らすための妥当性研究、PMDAによる妥当性研究のガイドラインなどに触れていくことで、「薬剤疫学研究において、なぜより正確なア[…]
Data Management Planについて
本ガイドラインで特に「おお」と思った点は、RWD研究においてデータの質を担保するために行うべきことが、データ所有者・研究者それぞれに分けて詳細に記述されていたことです。
日本の製造販売後調査でもデータの信頼性保証をデータベース事業者・製薬企業に求められていますが、ぶっちゃけ「何を示せば信頼できるのか」という指標が曖昧であり、困惑していた方々も多いと思います。そこを明示しにいったというところに本ガイドラインの意義を感じました。
Analysisについて
解析について、まず特筆すべきは「Statistical Analysis Planをちゃんと事前にかけよ」と明示されている点。これ、製薬企業の人間からしたら「当たり前やろ」という感じですが、アカデミアだとSAPを書かずにRWD研究をしている方が多くいると思うのでカルチャーショックがあるでしょう(製薬、意外とちゃんとやっとんねん)。SAPは「それを読めば完全に解析を再現できる」という粒度で書くことが求められます。
Primary Analysisについて、「これは書けや」という項目が印象深かったので抽出します。
- Descriptive analyses
- Subgroup analyses
- Methods of estimation and associated assumptions needed for analysis
- Estimate of the anticipated study size/power/statistical precision
- Plans to control for confounding and bias
- Assessment of population comparability
- Sensitivity analyses
- Type Ⅰ error control
- Assessment of representativeness
- Plans for handling missing data
とっても網羅的だね!!!
特にRWD研究の経験が乏しい方だとSensitivity analysesやAsessment of population comparabilityはスルーしがちですが、大切なのでしっかり書きましょう。
Special Population
RWDの強みの一つはそのデータ規模の大きさにより、臨床試験では包含できなかったコホートを包含できる可能性があることにあります。たとえば高齢者、小児、妊婦などですね。この中で、妊婦は特に特別な方法論を必要とするPopulationであり、世界中の研究者が「どうやったら妊婦の研究をうまいことデザインできるか」と頭を悩ませてきました。
本ガイドラインでもPregnancy Studiesと独立した節を作り、気をつけるべき点を解説しているのでぜひ一読されると良いでしょう。
終わりに
いかがでしたでしょうか?
まさに「やるべきこと全部盛り!」なガイドラインであり、RWD研究をする方はぜひご覧になるべきガイドラインでしたね。私も読むの大変でした笑。
すきとほるからのお願い
本ブログは、読者の方が自由に記事の金額を決められるPay What You Want方式を採用しています。
学生さんや経済的に厳しい方からはお金を取りたくなく、それが経済格差に起因する学力格差へと繋がると考えるからです。
仕事の合間に記事を書く時間を見つけるのはちょっぴり大変ですが、今後も皆様の「研究生活をほんのり豊かに」できる記事をお届けし続けたいと思っております。
なのでお金に余裕があり、そして「勉強になった!」、「次も読みたい!」と本ブログに価値を感じてくださった場合は、以下のボタンをクリックし、ご自身が感じた価値に見合うだけの寄付を頂戴できますと幸いです。
励みになるので、ご寄付はとてもありがたいです!
引き続き情報発信していく活力になりますので、ぜひお気持ちに反しない範囲でご寄付をお願い致します!









