こんにちは、すきとほる疫学徒です。
ここからしばらくは、薬剤疫学の曝露定義について一連の記事を書いていく予定です。
個人的には、2次的RWDを用いた薬剤疫学研究において、最も厄介なのがこの曝露定義だと思っています。
そもそも、2次的RWDで取得できるのは処方エピソードだけであり、内服エピソードは入手できません。
そのため、注目している薬剤が頓服や外用薬だったりすると、一気に研究の難易度があがります。
また、定期の内服薬が研究対象だったとしても、我々人間は処方された通りに薬を飲むことの方が稀ですので、「1日3回 30日分の処方が出てるから、30日間を曝露期間としよう」などと考えると、現実とのずれ、つまり誤測定バイアスが生じる可能性があります。
20代の若く、比較的時間がある方でも、「飲み忘れちゃった」、「めんどくさいし、なんか治ってきたから飲まないでいいや」ということで内服漏れすることがあります。いわんや多忙な社会人、認知機能が低下している高齢者をや、です。
また特定の薬剤を割り付け、患者に不利益のない範囲でその薬剤への割り付けを継続できるような治験環境と違い、リアルワールドでは別の薬剤への切り替え、追加は当然発生するわけですね。
仮に電子カルテを見れるならば、「A薬の効果が乏しいため、B薬に切り替えた」なんて感じで、切り替えエピソードを明確に特定できるかもしれません。
しかしながら、2次的RWDを扱う際に我々の手元にあるのは、診療報酬に残された処方薬、処方日、処方日数などのデータのみです。
ここから、「このタイミングでA薬が出て、その後B薬が出ているってことは、これは切替か?でも、そのあとまたすぐにA薬が出てるから、B薬は一瞬試しただけで、結局A薬のままいったのかもしれない」などのように薬剤の切り替え・追加があったのか、それとも内服継続だったのかなどと推理していかないといけないわけですね。
しかしながら、当然数千、数万人分の患者に対して個々の処方データを見て、曝露定義を決めるなんてことはできないわけですから、一律で「薬剤Aの後に薬剤Bが処方され、さらにその1ヶ月以内に薬剤Aが処方されなかった場合、薬剤Bへの切り替えとみなす」などの定義を適用せねばなりません。
さて、どう定義しますか?
想像するとちょっと頭が痛くなります。。。
薬剤曝露を定義するうえで、考えなければならない要因はなんでしょうか?
これから書く一連の記事では、そういった薬剤曝露の定義方法を紹介していきたいと思います。
Persistencyの定義方法
さて、初回ですので比較的シンプルなテーマからいきましょう。
それは、「同じ薬剤への曝露が継続しているか、中断したかをどう定義するか(Persistency/discontinuation)」というものです。
手元にあるデータがこんな感じの時に、
【患者X】
1回目処方:2022年1月1日 薬剤A 30日
2回目処方:2022年2月25日 薬剤A 60日
3回目処方:2022年6月1日 薬剤A 60日
いったい患者Aを「どの時点まで薬剤Aに曝露していた」と定義しますか?
些細な問題に見えるかもしれませんが、これ意外と大切です。
薬剤Aの曝露と有害事象Yとの因果関係を特定するために観察研究を行おうとしましょう。
この時、患者Xのデータには2022年9月1日に有害事象Yの記録があったとします。
その際、患者Aが「2022年9月1日時点で薬剤Aに曝露していたかどうか」ということによって、有害事象Yが曝露あり群でのイベントなのか、なし群でのイベントなのか、180°判定が変わってしまうわけですね。
この定義によって、有害事象の発症頻度も変わりますし、相対リスクも変わってしまいます。
そのため、薬剤への曝露継続を定義する際には、「どうしたらバイアスのリスクを減らし、より真実に近い曝露継続定義を設定できるだろうか」と考える必要があるわけですね。
さて、そんなPersistencyですが、設定する上でGrace periodなるものを考えてやらねばなりません。
また、後述しますがPersistency(曝露期間)とリスク期間は異なるため注意が必要です。
図にするとこんな感じ。
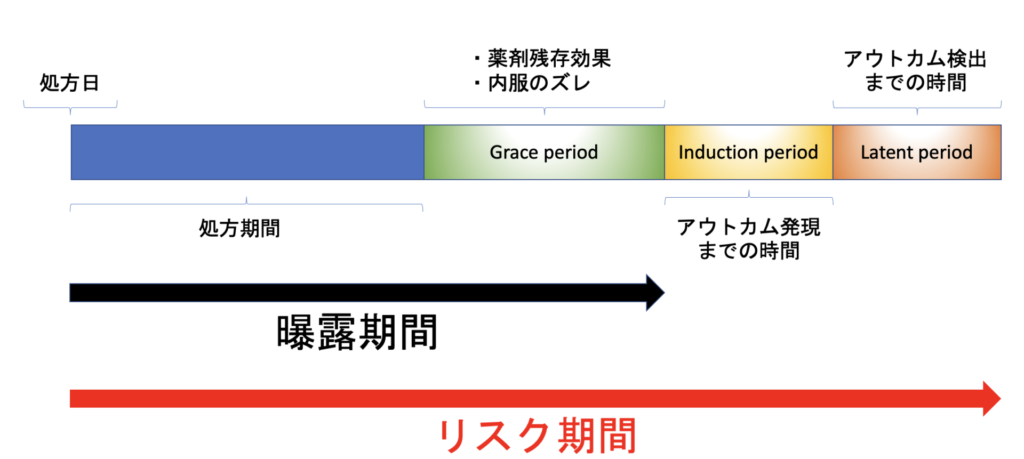
順に説明していきましょう。
なお、この記事では話をシンプルにするために、主たる薬剤への曝露以降に、比較薬となる薬剤へのswitching・add-onは発生しないと仮定します。
Switching・add-onも丁寧に処理しなければ誤測定バイアスをもたらす重要なイベントですが、そちらの説明は薬剤曝露シリーズの別の回で行う予定です。
Grace periodについて
Grace periodの定義
Grace periodは曝露期間の図における緑色部分ですね。
Grace periodは日本語では猶予期間と表現されます。
Grace periodとは、「薬剤の処方がデータ上は途切れた以降も、X日目までは”曝露あり”とする」という期間のことです。
例えば、以下のような処方データが手元にあったとしましょう
青が入手できた処方データで、青いバーが各処方イベント+処方日数、そして青いバー同士の間が処方が確認されなかった期間です。
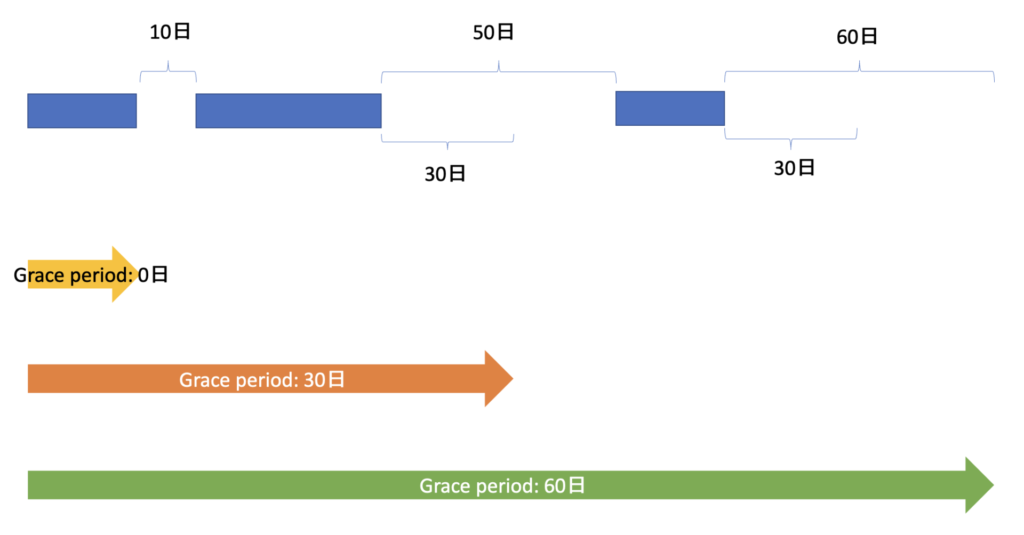
下の矢印は、それぞれ定義されたGrace periodごとの薬剤曝露の継続期間です。
0日(黄色矢印)の場合は、Grace periodがありませんので、処方期間に空白ができた瞬間、”処方中断(discontinued)”と定義されます。
次に、30日(オレンジ矢印)の場合は、30日までは処方期間に空白が生まれることを猶予するので、2回目の処方以降の50日間の空白のうち、30日目までは曝露継続と定義します。
最後に、60日(緑矢印)の場合は、60日までGrace periodを猶予するので、全ての処方期間の空白を、曝露継続と定義しています。
このように、Garace periodの定義を変えることによって、それぞれの患者において”どの時点で薬剤Aに曝露していたか”という定義が大きく変わることがお分かり頂けたかと思います。
Grace periodがなぜ必要なのか?
Grace periodは2つの理由から必要とされます。
一つ目は、薬剤の残存効果を加味するためです。
薬剤は、内服を止めた瞬間にぴったりとその影響がなくなるという類のものではありません。
投与後、血中に移行した薬剤は代謝や排泄で体外に排出されるまでは、体内に残存し、効果を発揮し続けるわけですね。
そのため薬剤の内服が終わっていたとしても、この残存期間は薬剤曝露ありと定義してあげる必要があります。
残存期間を推計する必要があるわけですが、これは前臨床・臨床試験において個々の薬剤の半減期が既に明らかになっていると思いますので、そのデータを参考にして決めると良いでしょう。
例えば、半減期が100日もある薬剤A(日常生活でそんな薬に出会うことはまずないと思いますが、思考実験だと思ってください)のGrace periodを60日しか設定しなかったとします。
すると60日から100日までの40日間は、本当は薬剤Aに曝露している期間のはずなのに、曝露なしと誤測定されてしまいます。
これが、Grace periodが必要な理由その1、薬剤の残存効果を加味するためでした。
二つ目の理由は、内服スキップによる内服期間のずれを加味するためです。
おそらくこの記事をお読みくださっている方の殆どが何らかの薬剤を定期内服された経験があるかと思いますが、実際に医師に処方された通りに薬剤を内服し続けるのってすごく難しいですよね。
忙しくて忘れてしまうことや、症状が軽快してきたから自己判断で内服頻度を下げてしまうことってあると思います。
高齢のご家族がいらっしゃる方などは、おじいちゃん、おばあちゃんの家に飲み残された薬剤が袋にどっさり入っていることを目撃したことがあるかもしれません。
Persistencyを定義する際には、この内服スキップによる内服期間のずれもしっかりと考慮してあげねばなりません。
例えば、1日1回2錠内服の薬剤を30日間処方されたとして、25日目までは医師の指示通り内服していたが、残りは症状が軽くなったために半量の1錠のみを内服し続けたとすると、実際に薬剤を内服し続けた期間は処方データに記載されている30日ではなく、25日+10日(残り50錠を1日1回内服するので)=35日となります。
推奨されるGrace periodについて
さて、ここまででGrace periodが必要な理由、そしてどのような根拠で設定すれば良いかを説明してきました。
次に、推奨されるGrace periodについて説明していきます。
Grace periodの推奨期間はもちろん薬剤によって変わります。
例えば、半減期が一瞬で終わり、もしくは飲み忘れがほぼ発生しないような薬剤(免疫抑制剤など)であればGrace periodは30日程度で良いかもしれません。
一方で、半減期が長い、もしくは飲み忘れが頻回に発生しそうな薬剤(高血圧の薬など)であれば、60日〜90日程度のGrace periodが妥当かもしれません。
レビュー研究が見当たらなかったため、私の所感でしかないのですが、日本の薬剤疫学研究だとGrace periodは60〜90日と設定している研究が多いと感じています。
これは、「日本の診療プラクティスだと、定期内服を続ける患者は少なくとも2〜3ヶ月に1度は医療機関を受診しているだろう」という推測のもと、「最終内服から2〜3ヶ月経っても追加の処方を受けていなければ、それはその薬剤使用を中断したとみなしていいよね」という仮定を立てているからだと思われます。
ここで一つ、面白い研究を紹介しましょう。
Grace periodを複数設定し、それによりPersistencyや曝露に関連したアウトカム発症頻度がどう変わるかということをシュミレーションした研究です。
筆者らは100人の患者の1080回分の処方エピソードを含む仮想のデータセットを構築しました。
この時、”Grace periodなし(Grace -)”と”Grace period90日間(Grace +)”という2つのPersistency定義のもとで、Persistency期間、中断と判定された患者数、曝露に関連したアウトカム発症頻度を比較しています。
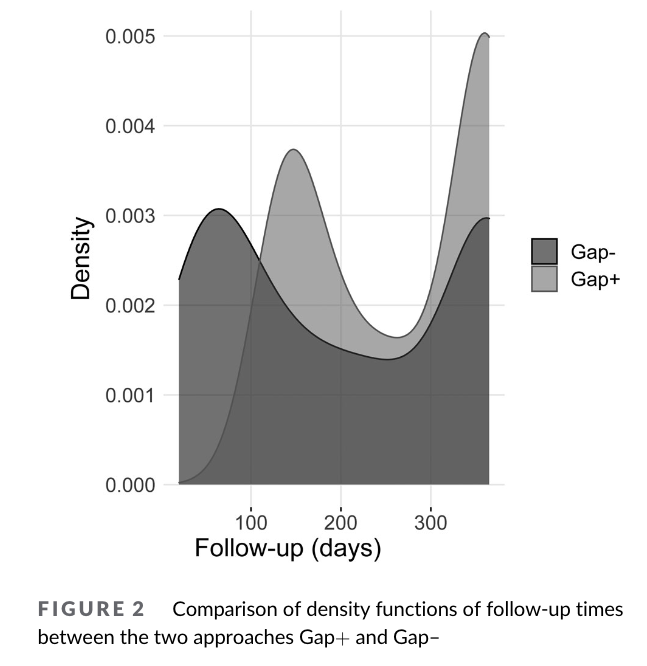
まずPersistency期間の中央値ですが、Grace -で183日(IQR 50-365 days)、Grace+で273日(IQR 140-365 days)と大きく差が出ました。
下図は両群でのFollow-up期間別のDensityを表しています。
次に薬剤の中断者の数ですが、Grace -で38人、Grace +で0人と、ここでも大きな差が出ています。
また、アウトカム発生頻度にも差があり、Grace -で0.82 events/person-years、Grace +で0.98 events/person-yearsとなりました。
その結果、Grace -をreference groupとした際のgrace -とgrace +間でのアウトカム発生リスクの比は1.20 (95% CI: 0.72-2.02)となっています。
下図は両群における曝露期間・非曝露期間それぞれのアウトカムの累積発生率です。
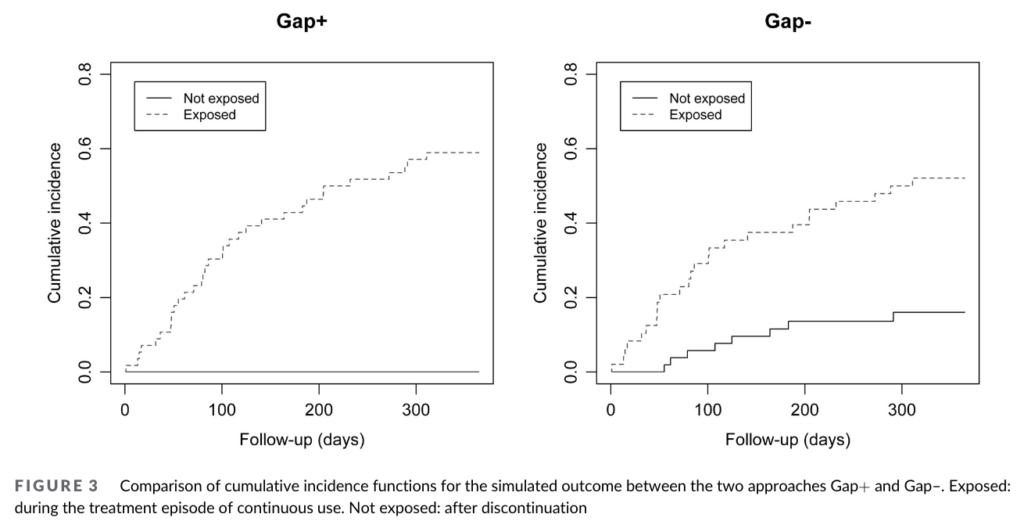
ご覧の通り、Grace +ではそもそも中断者がいないため非曝露期間が存在せず、非曝露期間のアウトカム発生もありません。
一方で、Grace -では38人の中断者が存在したため、非曝露期間でのアウトカム発生が観測されています。
仮に、「薬剤Aに曝露した患者をコホートとし、曝露期間と非曝露期間でのアウトカム発生頻度を比較する」というような研究を行なったとすると、同じ患者、同じ薬剤、同じアウトカムを設定しても、Grace periodの定義によって研究結果が大きく変わるということが想像できるかと思います。
なお、このシュミレーション結果を受けて、筆者らは「Grace periodを設定せずにPersistencyを定義してしまうと、特に曝露初期において薬剤中断の発症を過剰に見積もってしまう」と述べています。
また、「Grace periodを設定しない場合、薬剤の曝露期間、そして結果的には曝露群でのアウトカム発症頻度を低く見積もることになる」とも述べていました。
本研究は、ゴールドスタンダードを用意していないシミュレーション研究ですので、”真実(ゴールドスタンダード)と比べて、推定が過剰だったか過小だったか”と言うことはできないと思うので、私個人としては筆者の”過剰”・”過小”という表現が何を根拠としているかはわかりませんでした。
しかし、Grace periodの設定理由で説明した通り、リアルワールドのプラクティスを考えれば、薬剤の残存効果や内服のズレによる内服期間の延長は発生しうると考えた方が妥当ですので、Grace periodは設けるべきでしょう。
また上記のシュミレーションとは関係ありませんが、筆者らがあげていたGrace periodを設定すべき理由の一つとして、immortal time bias・selection biasを防ぐというものがあります。
まず、患者を前向きに追跡するコホート研究においては、薬剤の継続は
- 処方日+処方期間を観察する
- しばらくGrace periodを設けて、次の処方がないか観察する
- Grace period中に次の処方があれば処方継続、なければ中断とする
というように、Grace periodの観察を経てから処方の継続・中断が判断されるのが一般的でしょう。
しかしながら、医療大規模データベースを用いて後ろ向きに患者を追跡するコホート研究においては、既に全てのデータが手元に揃っているため、
- 処方日+処方期間を観察する
- それ以降に処方がなければ、中断とする
- あればGrace periodを加えて、処方継続を定義する
というように、「未来の処方の有無によって条件づける形で過去の薬剤曝露を定義する」ということが可能になってしまいます。
この際、曝露群の包含条件として複数処方を必要とするような条件が設けられていると、2回目処方がある患者(つまり曝露群)のみ1回目処方と2回目処方の間のGrace periodが追跡期間としてカウントされ、immortal time biasが生じます(immortal time biasの説明はまた別の記事でする予定です)。
また、曝露群を未来の処方の有無で定義していますので、Selection biasが生じるリスクもあります。
これらの理由からも、やはりGrace periodはゼロではなく設定した方が良いと言えるでしょう。
なお、私個人としては”Grace periodは絶対に90日”と言えるような強い根拠がなければ、60日、90日、120日などと複数定義を設定して、感度分析を行うことを推奨されると考えています。
特に薬剤安全性の研究では、上記シュミレーションで起こっていたように、Grace periodを短くする or 設定しないことにより、曝露群でのアウトカムを非曝露群に押し付けることが可能になってしまうため、Grace periodを研究者の都合で短く設定し、見かけ上の有害事象の発生頻度を低くするという操作が可能になってしまいます。
これを防ぐためにも、複数のGrace period下で算出された結果を比較し、その頑健性を確認すべきでしょう。
Induction periodとLatent periodについて
さて、薬剤のPersistency(曝露期間)はGrace periodを考慮することで定義できることを説明してきました。
しかしながら、Persistency=リスク期間(追跡が必要な期間)ではないということに注意が必要です。
なぜなら、薬剤への曝露が終了した後も、アウトカムを発症することがあり得るからです(リスク期間)。
ここから先はPersistencyの定義とは異なる話ですが、誤解を招きやすいため合わせて説明したいと思います。
Induction period(誘導期間)とLatent period(潜在期間)という2つの概念を用いて、リスク期間の説明をしていきましょう。

Induction period: アウトカム発症の最初の因子発現から最後の因子発現までの時間
Latent period: アウトカム発現から観測可能になるまでの時間
です。
後者はシンプルですが、前者はちょっとややこしい言い回しになってしまいました。
例えば、薬剤Aが有害事象として懸念される肺癌のリスクを上昇させるかどうかというモチベーションで研究をしたいとします。
この時、真に薬剤Aが肺癌の原因であったとしても、薬剤Aに曝露した1秒後から肺癌を発症することはありませんよね。
思考1. 「薬剤Aに曝露してから肺癌が発現するまでには、1年くらいかかるかな」
思考2. 「肺癌が発現しても、最初はめちゃくちゃ微小な腫瘍で、観測可能になるまでは数習慣かかるかな」
思考3. 「これらの期間を考えると、薬剤Aに曝露してから1年半くらいは観察を継続しないといけないな」
というように考えるのが妥当だと思います。
この時の思考1がInduction periodに該当し、思考2がLatent periodに該当するわけですね。
つまり、仮にターゲットとしている薬剤が真に有害事象を起こすとしても、Induction periodとLatent periodを経なければそのアウトカムは理論上は観察できないため、曝露期間終了後もリスク期間として観察を継続する必要があるわけですね。
まとめると、
薬剤へのPersistency(曝露期間):処方日+処方日数+Grace period
薬剤によるリスク期間:Persistency+Induction period+Latent period
となります。
ただ、上図は”薬剤曝露期間の最後の時点でアウトカム発症の最初の因子が発現する”というかなり保守的な仮定を置いていますが、実際には曝露期間の途中から既にInduction period、Latent periodが始まっているという可能性ももちろんあります。
ですので、曝露期間終了後にどれだけリスク期間として観察を継続する必要があるかは薬剤によって異なり、設定の際には臨床試験のデータから「有害事象Xは中央値では曝露X日目で発現している」などと考えながら設定するのが良いと思います。
終わりに
さて、いかがでしたでしょうか?
曝露のPersistencyを定義する際に考えるべきGrace period、そしてPersistencyとの誤解を防ぐためにリスク期間としてのInduction period、Latent periodの説明をして参りました。
比較的シンプルな概念だったので、すんなりとお読み頂けたかもしれませんが、この後には大変やっかいなswitching・add-onの話が控えているため、その準備体操がてらお楽しみ頂ければと思い、執筆致しました。
なお、薬剤疫学分野の記述疫学研究では、薬剤のPersistencyの他にAdherenceを求める研究というものがポピュラーです。このAdherenceと今回説明したPersistencyの違い、お分かりになりますでしょうか?
ややこしいことに、この2つの概念、算出方法が異なる全く違う概念なんです。
おまけに、Adherenceの算出方法にも大きく分けて2種類の方法があったりしまして。。。
というわけで薬剤曝露シリーズの一環として、近々Adheranceの定義についても説明していきたいと思います。
それでは、本日もご覧くださりありがとうございました。
すきとほる疫学徒からのお願い
本ブログは、読者の方が自由に記事の金額を決められるPay What You Want方式を採用しています。
「勉強になった!」、「次も読みたい!」と本ブログに価値を感じてくださった場合は、以下のボタンをクリックし、ご自身が感じた価値に見合うだけの寄付を頂戴できますと幸いです。
もちろん価値を感じなかった方、また学生さんなど金銭的に厳しい状況にある方からのご寄付は不要です。
引き続き情報発信していく活力になりますので、ぜひお気持ちに反しない範囲でご寄付をお願い致します!








