こんにちは、すきとほる疫学徒です。
先日公開した薬剤曝露シリーズ②では、Persistenceについて取り上げました。
本日は、Persistenceとよく似た定義であるAdherenceについて取り上げようと思います。
唐突ですが、PersistenceとAdherenceがどう違うか、皆さんお分かりになりますか?
実は私も昨年までよく分かっておらず、ちょうど某疾患領域の薬剤使用実態に関する論文を書いた際に、「あれ、このリサーチクエスチョンだと使うべきはPersistency?Adherence?というかその2って違う指標なの?」と自分の不理解に気づきまして、急ぎ勉強し直しました。
こちらの記事の中ではPersistenceとの比較という形でAdherenceを紹介していきますので、前回の記事からお読みいただけますと、一層楽しんで頂けるかなと思います。

「RWD研究の支援をしてほしい」というご相談を多くの企業様から頂戴するので、企業様向けに正式に窓口を設置しました。
以下のアドレスに連絡頂ければ私に直通しますので、「1時間の無料相談」も含めてお気軽にご連絡ください(3営業日以内にお返事させて頂きます)。無料相談は大変ご盛況となっており、先着順にて対応させて頂いております。
お問合せ先:naoki.hirose@mmedici.co.jp(廣瀬個人アドレス)
私が経営するmMEDICI株式会社ではRWD利活用支援を事業の柱の一つとしており、以下の強みを有しています。「企業の」RWD研究においては日本トップクラスの解像度と経験値を有する自信がありますので、ぜひ無料相談でご体験くださいませ。
- 元大手外資の日本・グローバル出身の疫学専門家が全案件を担当するので、「企業の」RWD研究に高い解像度を有しています
- ただ成果物を納品するだけでなく、グローバルやKOLとの合意形成、社内プレゼン、規制当局対応などRWD研究の「プロセス」も全てまきとれます
- 企業のRWD研究を幾度となく経験しており、企画立案から論文化までの全フェーズを一気通貫で対応できます
- アカデミアのRWD研究者と広い繋がりを有しており、必要に応じた専門人材のアサインが可能です
- RWD研究だけでなく、事業立案、マーケ、広報、営業などのRWDビジネスも全て対応可能です
以下に私の実績を記載させて頂きます。
- 大手外資製薬2社にて、部門唯一の疫学専門家として活動をリード
- 「RWDビジネスの教科書」の書籍を出版(サイドバーをご覧ください)
- 企業でのRWD研究の経験は50本以上
- 製造販売後データベース調査のリード経験多数
- これまで製薬、CRO、コンサル、総合商社、ヘルステックなど10社以上の企業のRWD研究・RWDビジネスを支援
- 50組織以上にRWD研修を提供
- 全体統括・講師を勤めたJapan RWD Summitでは初回から約1,700名の集客を実現
無料相談では、以下のような内容を含め企業様の「RWD」と名のつく相談でしたら全て対応させて頂きます。
- このテーマでRWD研究はできるの?
- RWD研究っていくらくらいかかるの?
- RWD研究ってどんなプロセスでやれば良いの?
- 製造販売後データベース調査のやり方を教えてほしい
- RWD研究をするにはどんな専門家を雇えば良いの?
- 自社のRWDサービスを売りたいんだけど、強みはどこ?集客はどうすれば良い?
無料相談は先着順での対応となりますので、ご希望の企業様はぜひお早めのコンタクトをお願い致します!
お問合せ先:naoki.hirose@mmedici.co.jp(廣瀬個人アドレス)
Adherenceの定義方法
さて、「Persistenceとは微妙に異なる」とお伝えしたAdherenceの定義ですが、どんなものでしょうか?
Adherenceとは一般的に、「患者がどの程度処方スケジュールに従い薬剤を内服したか」ということを指します。一方Persistenceとは一般的に、「患者がどの程度薬剤を内服し続けたか、もしくは薬剤の内服開始から中断まで」を指します1。
「一般的に」という言葉が気になりませんでしたか?
なぜ「一般的に」という言葉をつけたかというと、このAdherenceとPersistenceという用語、論文によって定義や計算方法が大きく変わっているのです。
ですので、Adherence・Persistencyという用語を論文中で見つけた際には、「それぞれどのような定義で用いられ、計算されているか」ということをしっかり確認した方が良いでしょう。
そうでないと、同じ薬剤のAdherence・Persistenceを計算した論文AとBを見比べても、実際はそれぞれの論文で見ているアウトカムが全く違った、ということになりかねません。
そのような状況を懸念し、研究者らは医療データベース研究における論文ごとのAdherence・Persistenceの定義、計算方法の違いを調べるためのSystematic review研究を行いました。
Table1が包含された文献のリスト、Table2が定義・計算方法の差異です。
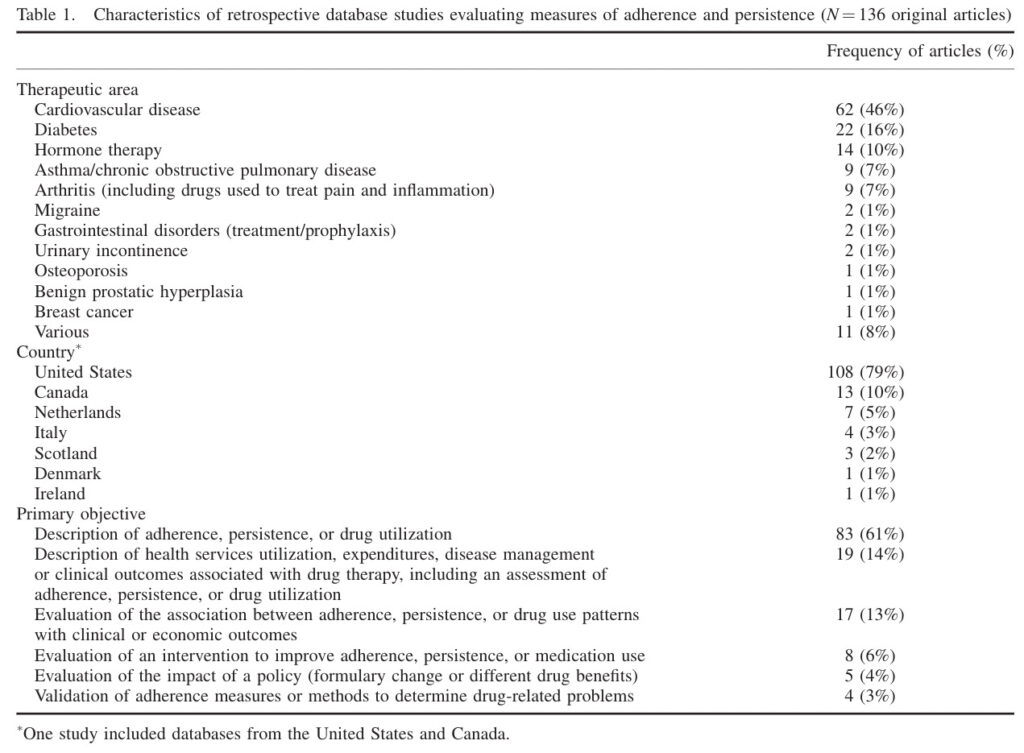

Adherenceの計算方法は次の項で説明するため、詳細は省きますが、ご覧の通り論文ごとにAdherence・Persistenceの定義・計算方法がばらついていることがお分かり頂けるかと思います(Table2はAdherenceとPersistenceについて別々に記載すべきだと思うのですが、なぜかまとめられており、どっちがどっちの意味で使われたのか分かりません)。
なお、Table1をご覧頂ければ分かる通り、79%が米国で行われており、日本とは保険システムや使用可能なデータベースに差異があるため、この結果を直接日本に外挿できるかという点は冷静に判断が必要です。
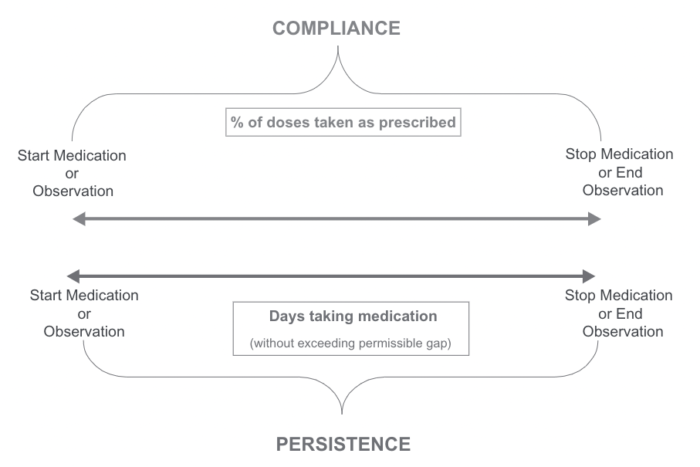
ちなみに、ISPORも同様にAdherenceのTerminologyに関するSystematic review研究を行なっており、その結果として、
Adherence: The extent to which a patient acts in accordance with the prescribed interval and dose of a dosing regimen
Persistence: The duration of time from initiation to discontinuation of therapy
と定義するのが良いのでは?と提言しています2。
その定義をまとめたグラフがこちら(四角の中の言葉以外両者変わっていないので、もはやグラフにする必要があったのか謎ですが)。
そして、Adherenceを具体的に説明したTableがこちらです。
一人の患者における9週間の連日の内服を分子に、そして”内服すべき”とされた日数を分子に計算されており、最初の4週間は内服漏れがないためAdherence100%、しかし2ヶ月目には36%まで低下したことになっていますね。
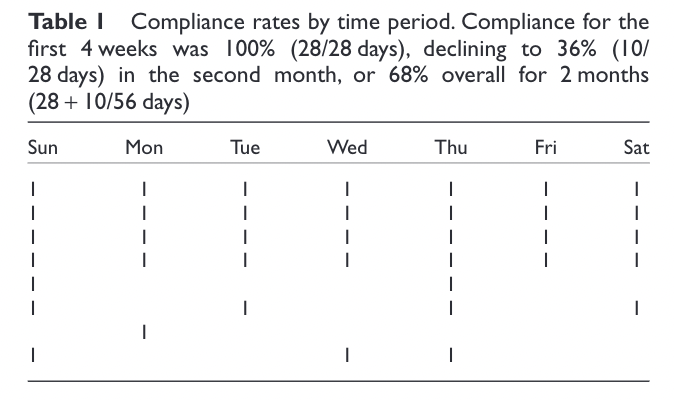
余談ですが、このようにAdherenceは”どの期間を分母とするか”によって大きく数字が変わりますので、Research questionとしてAdherenceに着目している期間がどの期間であるかというのは、しっかりと研究開始前に明らかにした方がよいでしょう。
でないと、研究者に都合の良い期間だけを切り取ったAdherenceを提示するというチェリーピッキングに繋がってしまうリスクがあります。
Adherence・Persistenceに関する論文は本当に沢山あるのですが、医療大規模データ研究をやるにおいてAdherence・Persistenceの定義・計算方法を参照するとしたら、以下のSystematic review論文が参考になると思います3。

この論文が「良いな」と思った点の一つ目は、Adherenceの定義を何段階かに分けて提案しているところです。
Adherenceに対して、Primary Adherence、Secondary Adherence、そしてAdequate Adherenceと3つのlower levelな定義を提案していますね。
上から順に、Primary Adherence、Secondary Adherence、そしてAdequate Secondary Adherenceです。
Primary Adherence:処方箋発行から特定の期間の間に新規の調剤を受けること
Secondary Adherence:”Primary Adherence”を満たした患者のうち、初回処方の内服終了技から特定の期間の間にリフィル(再調剤)を受けること
Adequate Secondary Adherence:初回処方から測定期間終了までの間で薬剤内服日数が80%*を超えていること
*80%という数字は、「only rarely with supporting evidenceだが、このカットオフがcommonlyに使われる」と但し書きされています。
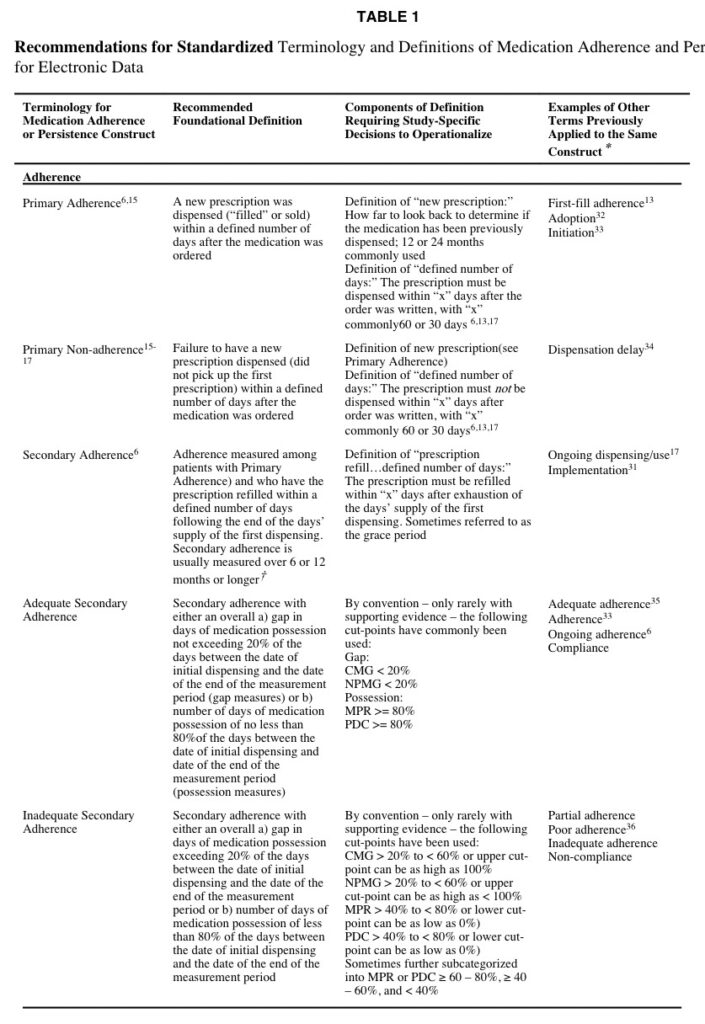
Adequate Secondary AdherenceはSecondary Adherenceの下位定義ですので、大きく分けるとPrimary AdherenceとSecondary Adherenceがあることになります。
これは、薬剤の服用行動における受容(acceptance)と持続(persistence)という異なる2つのステージがあることを反映したのかもしれません4。
受容とは処方薬の初期の導入段階における内服遵守を指し、持続とは患者がレジメンに従う長さを指します。
前者のNon Adherenceは、例えば「処方はされたが、薬剤費を理由に調剤を受けない」ことで生じる一方で、後者のNon Adherenceは、例えば「定期的に調剤を受けているが、たまに忘れてしまって調剤期間が空いてしまう」ことで生じます。
受容段階において(つまり処方箋をもらった後に)「調剤してもらうのを忘れてNon Adherenceになってしまった」ということは、超激務の方か認知機能の低下した方でない限りはほぼ起こり得ないと思うので、論文の筆者らが提案しているようにPrimaryとSecondaryで定義を分けるのは妥当ですね。
なぜAdherenceを測定することが重要なのか
まず第一に、服薬Adherenceが保たれないことにより、回避可能な入院、医療処置を受けるリスクが高くなり、それにより患者の健康が害されると共に、医療費が増加するという医学、医療政策的な問題があります。
このため、Adherence自体が「着目すべきアウトカム」として扱われることもあります(例えば、HIVに対する抗ウィルス薬や経口避妊薬などは数日の服薬漏れが深刻な結果につながりうりますよね)。
第二に、薬剤疫学研究を行うにおいて、Non Adherenceは曝露の誤測定によるバイアス・交絡バイアスに繋がるリスクがあるからです。
薬剤疫学研究に携わる方にとっては、こちらの方がよりリアルな問題として感じられるかもしれません。
誤測定バイアスですが、仮にターゲット薬剤群と比較薬群のどちらががアウトカムである疾患の発症リスクを真に増加させるとすると、Non Adherenceによる曝露の誤測定により、見かけ上は発症リスクを増加させない方向へと(Bias towards the null)へとバイアスがかかります。
次に交絡バイアスですが、仮にターゲット薬剤群と比較薬群のどちらかにおいて、DifferentialにAdherenceが異なっていたとしましょう。
この時、おそらくAdherenceの高い患者というのは健康意識が高く、日頃から薬剤のAdherence以外にも食事や運動など色々と気を使った生活を送っている可能性が高いので、アウトカムである疾患の発症リスクも低いかもしれません(Healthy user biasですね)。
これにより、ターゲット薬剤群と比較薬群の真の効果ではなく、その背後にあるHealthy userという交絡因子により、見かけ上どちらかの疾患発症リスクが低く見えてしまうというバイアスがかかるリスクがあります。
例えば、薬剤Aが薬剤Bと比較して、アウトカムYの発症リスクを低下させるかというリサーチクエスチョンで医療データベース研究を行う際にも、先行研究によって薬剤Aと薬剤BへのAdherenceが明らかになっていれば、研究結果のDiscussionをする際にも誤測定バイアスや交絡バイアスのインパクトがどれくらいあるかということをエビデンスベースドで検討しながら、Discussionを展開することができるわけですね。
余談ですが、Drug Adherenceと聞くと、多くの方が「服薬漏れ」を想像するかもしれません。
しかしながら、服薬漏れだけではなく過剰服薬もまたNon Adherenceとして捉えられます。
引用文献を出せないので大変恐縮なのですが、フランスでDrug abuseの発生頻度を測定するために医療大規模データベースを用いた記述研究が行われまして、その研究では「Overlapした時期に、複数医療機関から同薬の処方を受けていること」をもってDrug abuseと定義しました。
私もプライベートの研究でDrug abuseをアウトカムにして医療大規模データベース研究をやってみようかと考えていたのですが、上記の研究のようにOverlapした複数医療機関の処方=Drub abuseと定義するのはやや無理がある(アウトカムの誤測定のリスクが大きすぎる)のではないかと思い、結局自分の中でボツにしました。
とはいえ、質問紙などのPrimary data collectionでDrug abuseがより正確に把握できるかというと、それも疑問です。Drug abuseを経験している患者はおそらく医師やデータの収集元に「薬剤を乱用してます」と自己報告することは稀でしょう。
また、複数医療機関を渡り歩く形で薬剤を手に入れているのであれば、個別の医療機関の医師からデータを収集しても、Drug abuseの現状は見えてきません。
となると、もはや患者の血中濃度を測定するなどという方法しか思いつきませんが、これはデータ入手のための負荷が大きすぎますし、それにやはりDrug abuseを経験している患者が自発的に採血に協力することも稀でしょう。
であれば、医療大規模データベースでDrug abuseを測定するという試みは、limitationは非常に大きいけれども、相対的には選びうる選択肢かもしれませんね。
Adherenceの測定方法
さて、ここまではAdherenceの定義、そしてAdherenceを測定することの重要性について話してきました。
ここからは、「そんなAdherenceをどう計算するのか」という話をしていきましょう。
ちなみに、Adherenceの計算方法も元となるデータソースが患者の自己報告なのか、電子服薬モニターなのか(服薬のために薬ボックスのボタンを押すと、それが記録されるなんていう装置もあるらしいですね)、薬物濃度なのか、医療大規模データなのかによって変わりますが、ここでは医療大規模データを用いたAdherenceの計算方法に着目してお伝えします。
医療大規模データベースを用いたAdherenceの計算方法には、大きく分けてMedication posession ratio (MPR)とProportion of days covered (PDC)の2種類があります5。
計算方法は、
MPR = (Sum of days supply) / (Todal days in period) x 100
PDC = (total days covered) / (Total days in period) x 100
です。
一見すると、「え、何が違うの?」という感じですよね(私もしばらく眺めたり、図に描いたりしてようやく気づきました)。
図の方がわかりやすので、そちらで見ていきましょう。
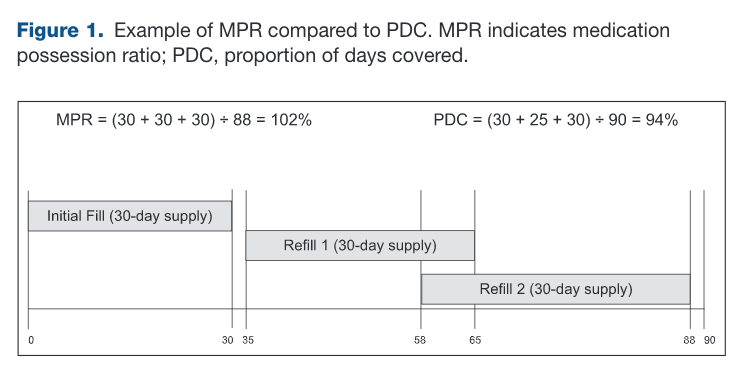
MPRとPDCで分母のTotal days in supplyの定義が地味に異なっているようで、MPRは”最後のRefillにおける最終内服日まで”、そしてPDCでは”90日間という一定の期間”となっているようです。そのため、図中の計算での分母が88日、90日とずれているようですね。
しかし、論文の本文中の計算式ではMRP・PDC共に分母に”Todal days in period”とのみ書かれているため、非常にわかりにくいと思います。
しかしながら、MPRとPDCの最大の違いはそこではないため、一旦ここは置いておきましょう。
MPRとPDCの最大の違いは、MPRが薬剤が処方された日はRefillごとにカウントしているのにたいして(つまり、Refill1とRefill2の58-65がダブルカウントして分子に計上されます)、PDCの場合はRefill間で日数のOverlapがあっても1日あたり1回までしかカウントしていません(つまり、Refill1とRefill2の58-65がダブルカウンされず分子に計上されます)。
ご覧の通り、MPRでは観察期間中にRefillのOverlapがあると割合が100%を超えることがあるのに対し、PDCでは1日あたり1回までのカウントとなるため、Maxでも100%までにしかなりません。
割合データを見る際に、100%より大きい数字が出てくると結果の解釈に混乱が生じるリスクがあるため、MPRをアップデートした測定手法として開発されたのがPDCになります。
さて、もう少し丁寧にPDCについて説明していきましょう。
上で書かれている計算方法にはラフさがあるため、”標準化された計算方法”と呼ぶにはより詳細な情報が必要でしょう。
このような状況を受けて、National Association of Specialty PharmacyはPDCの計算方法について以下のような声明を出しました5。
ただし、読んでいる限りでは、この声明はアメリカの保険システム、処方行動を前提にしているように感じられたので、日本にそのまま外挿すべきかどうかは要検討だと思います。
Minimum fill criterion of 3 or more fills within the study period
これは、観察期間において3回以上の調剤を受けた患者だけをAdherenceの計算に用いるという提言です。
Adherenceを測定する目的は、「患者がどの程度服薬指示を遵守しているか」ということを明らかにすることですので、3回以上の調剤を受けた患者に限定することで、コホートを「継続してその薬局でサービスを受ける患者」に絞っているわけですね。
これは特に薬局レベルでのAdherenceを測定する際に重要になる基準で、なぜなら1回だけ調剤を受けた患者などを含めてしまうと、「その薬局では何らかの特別な理由があり一度調剤を受けたが、普段は別の薬局で調剤を受ける患者」などを誤って”1回目の調剤以降Adherenceなし”と誤測定してしまうリスクがあるからです。
やや理解しがたいコンセプトかもしれませんが、”Adherenceの定義方法”の項で書いたとおり、Adherenceの下位レベルには受容と継続というコンセプトがあることを考えれば、ここでいうAdherenceは継続の方を測定することを目的にしたもの、と考えれば、理解しやすいかもしれません。
Start date = first fill date
Adherenceを計算する際のタイムスケールは、”特定の期間中”ですので、その始まりと終わりを定義せねばなりませんね。
ここでは、初回調剤日をStart dateとすることが提案されていますが、この背景としては「幾つかの研究では、look-back periodを設け、in-hand(薬が調剤される以前の手持ちの薬剤?)を加味する」ということをやっていたらしいです。医療大規模データーベスではin-handの薬剤の状況は加味しようがないので、ここは特に難しく考えずStart date = first fill dateとして良いそうですね。
ちなみに、これを読みながら「なぜFirst prescriotion date(処方箋発行日)ではないのか?」と考えていました。もしかすると、これもAdherenceの受容と継続の下位レベルのコンセプトのうち、受容に該当する患者を除外するためなのかもしれません(First prescription date ≠ First fill dateの場合、非受容患者である可能性があるから)。
ただ、詳細は声明中には書かれていなかったため不明です。
いずれにせよ、日本でAdherenceを計算する場合はFill dateは分からず(調剤データがあれば別ですが)、Prescribed dateのみ取得できるというのが殆どだと思いますので、ここは大きな問題にはならなさそうです。
End date = date of last fill
こちらはAdherence計算のタイムスケールのうち、”特定の期間中”の終わりをどう定義するかという提言ですね。
End dateの定義では、一般的にはFixed interval(Date of last fill + X days)か最終のfill日が用いられますが、ここではX daysをプラスせずに、Date of last fillを用いることが提案されています。
Fixed intervalを用いることが推奨されない理由として、再び薬局レベルでのデータのみ手元にあることを想定しましょう。この場合、患者が別薬局で受けた調剤を追跡することができません。
その場合、例えば30日間のようにFixed intervalを設定してしまうと、患者が薬局AでのLast fillの後に薬局Bでfillを受けていた場合、その30日間のうち何日かはAdherence=○な期間のはずですが、薬局Aのデータ上はNon adherenceな期間として誤って分母に形状され、結果的にAdherenceが過小に見積もられてしまいます。
また、Last fill後に医師から薬剤処方が中止になっていた場合も、Last fillで観察を終了することで、”Lat fill以降の30日間は薬剤処方が中止になっていたが、間違って薬剤内服を遵守すべき期間に加えてしまった”ということを防ぐことができます。
なお、Last fillの日を最終調剤日にするのか、それとも最終調剤に調剤日数(day’s supply)を加えた日にするのか(例えば、30日分の調剤がされていれば、+30日)とするのかでも検討の余地があります。
声明では調剤日数は分母・分子ともに除外することが推奨されていました。
なぜなら、最終調剤日以降に患者が調剤日数分の薬剤を内服したがどうかはデータでは不明であり、にも関わらずこの日数を”内服あり”として分子にも加えてしまうと、過剰にPDCを見積もるリスクがあるからです。
Minimum evaluation period = 12 months
少なくとも12ヶ月の観察期間(First fill dateからEnd dateまで)を持つ患者だけをAdherenceの計算に使用しようという提案です。
これも最初に紹介した”最低3回のfillを受けた患者だけを含める”という提案のモチベーションと同じで、ある程度追跡できた患者だけをAdherenceの計算に用いた方が、「患者の服薬遵守行動を測定する」というAdherenceの目的に叶うよねというモチベーションからきている提案です。
Fill date = Sold date
最後の提案は、National Association of Specialty Pharmacyではなく、その声明を紹介した論文の筆者らによるものです5。
これまでの提案では、”Fill date”という言葉が繰り返し使われていましたが、「Fill dateっていつなのかはっきりしようぜ」というモチベーションでの提案になります。
Fill dateの候補としては、Adjudication date(薬局からBenefit managerに請求書が送られた日)、処方日(処方箋が発行された日)、薬剤の販売日、薬剤の輸送日(shipped date)、患者が薬剤をピックアップした日、薬剤が患者に届けられた日、領収書における受領日など多数ありえます。
このうち筆者らが販売日であるSold dateを推奨する理由として、「Adherenceが着目する患者行動は薬剤の内服であり、薬剤を販売した日が内服日と最も近いと考えるから」と書かれていました。
医療大規模データベースを用いてAdherenceを測定する場合は、殆どの場合は処方日しか使用できませんので、ここも日本では議論の余地は少なそうです。
Adherene測定における注意点
Adherenceの測定における注意点を紹介しましょう5。
Non adherenceの誤測定
上に述べたAdherenceの計算方法では、初回のFillから最後のFillまでの日数を分母とし、そのうちFillにより調剤された期間を分子としていました。つまり、FillとFillの間の期間をNon adhereneな期間と定義しているわけですね。
ここでは、「Fillがあり、そしてまたその次にFillがあったのなら、その間の期間は薬剤を内服し続けるべき期間である」と仮定されています。
しかしながら、実際にはFillとFillの間の期間においても、臨床的妥当性をもって休薬するということは十分に起こりうるわけですね。
FillとFillの間の期間で実際に何が起こっていたかを知るためには電子カルテデータなどの詳細情報を参照するしかありませんが、医療大規模データベースを用いた研究ではそのようなことはほぼ不可能ですので、FillとFillの期間はNon adherenceと定義せざるを得ないというlimitationがあります。
Adherence良好の閾値が十分に標準化されていない
上の定義でのAdherenceは割合で測定されますが、研究によってはX%以上のAdherenceがある患者をAdherence良好として、良好・不良の2値データに変換しているものもあります。
この時、Adherenceの閾値は「薬剤XのAdherenceがX%未満になると、その患者の疾病管理に悪影響を及ぼす」という臨床的妥当性に基づいて決定されるべきですが、残念ながら十分に研究されていません。
そのため、Adherenceを閾値を挟んで良好・不良の2値データに変換するのは、先行研究により遵守すべき閾値が明らかになっている場合のみに絞るべきでしょう。
終わりに
さて、いかがでしたでしょうか?
記事を書き始める前は、「まぁAdherenceなんてシンプルなコンセプトだから、楽に書き終えられるかな」とたかを括っていたのですが、調べていると意外と奥が深いことに気づき、かなり長くなってしまいました。
薬剤疫学研究をしていると毎度思いますが、本当に一つの変数の定義、期間の決め方とっても過去に様々な議論が積み重なって合意が形成されており(もしくは形成されておらず)、研究計画書や論文のどの部分をとっても、執筆において気が抜けません。
考えるべきことが次から次に出てきて、「もっともっと薬剤疫学研究を続けていけば、いつかそれほどリソースを使わずに研究を前に進められるようになるのかな」と淡い期待を抱いているのですが、そんなことはないのだろうと半ば諦めの境地です。
標準化された研究手法であっても、いざそれを生の研究に持ち込んだ際には、どんな反応を示すかというのは研究ごとに全く異なるはずだと思いますので、どれだけ薬剤疫学研究の経験を積み重ねていったとしても、毎度まいど研究ごとに丁寧に思考を積み重ねて、最善の研究デザイン・解釈ができるように常に緊張感を持たないといけないのだなと思っています。
反対に言えば、この緊張感を忘れてしまった時には、もう研究者失格なのかなとも思ったりして。
閑話休題。
Adherenceの話をしてきたはずですのに、なぜか突然薬剤疫学に関してナイーブな感情を吐露してしまいました。。。
長くなりましたが、本日はこれにておしまいです。
ご覧くださりありがとうございました。
すきとほる疫学徒からのお願い
本ブログは、読者の方が自由に記事の金額を決められるPay What You Want方式を採用しています。
「勉強になった!」、「次も読みたい!」と本ブログに価値を感じてくださった場合は、以下のボタンをクリックし、ご自身が感じた価値に見合うだけの寄付を頂戴できますと幸いです。
もちろん価値を感じなかった方、また学生さんなど金銭的に厳しい状況にある方からのご寄付は不要です。
引き続き情報発信していく活力になりますので、ぜひお気持ちに反しない範囲でご寄付をお願い致します!








