こんにちは、すきとほる疫学徒です。
薬剤曝露シリーズの④ということで、今回はActive comparatoについて解説していきます。
なお、Active comparatorはNew user designと並び、薬剤疫学の観察研究におけるゴールドスタンダードとして使用される手法であり、両者を合わせたデザインをACNUなどと評することがあります。
New user designについての解説は以下の記事で行なっておりますので、こちらの記事を併せてお読み頂けますと、薬剤疫学の曝露の扱い方に関する理解が一層深まるかと思います。
Active comparatorとは何か
本記事は以下の論文を参考にし、執筆されております。
Active comparatorとは、ターゲット薬の比較群として、薬剤を使っていない患者群(Non user)ではなく、ターゲット薬と適応が同じであり、かつターゲット薬の使用が禁忌ではない患者群を選択することを言います。
たとえば、インスリングラルギンの長期使用がその後の発癌リスクに与える影響を調査する際に、Active comparatorではインスリングラルギンと適用が近しいと考えられるNPHヒトインスリンを比較群に設定するなどです。
ちなみにActive comparator designの反対は、Non user designであり、インスリングラルギンに対し、抗糖尿病を使用していない患者を設定することを指します。
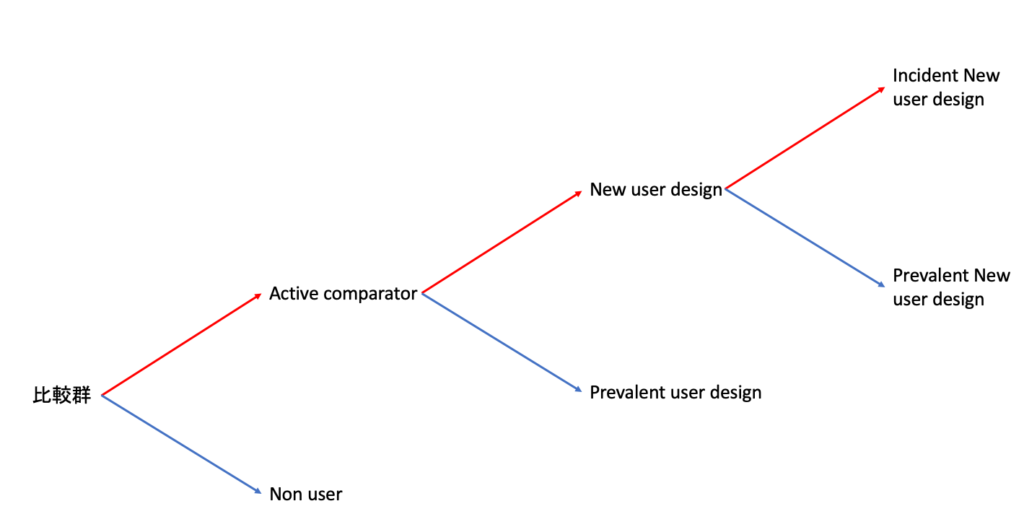
なお、比較群の選択法をフローにすると以下の通りで、赤線で引かれているところが、薬剤疫学の観察研究において最も内的妥当性を向上させる(バイアスの影響を最小化する)ゴールドスタンダードとされています。
冒頭で述べた通り、Active comparatorを選択した後のフローは本記事冒頭に引用した過去記事で解説しているので、そちらをご覧ください。
ACNUデザインがゴールドスタンダードとされる理由は、ACNUを用いることで、介入の設定という観点からは、”背景がバランシングされた患者間において、薬剤の割り付け時点から患者を追跡し、アウトカム発症リスクを比較する”というランダム化比較試験を模倣した研究デザインを組むことができるからです。
いわゆるTarget trial emulationという考え方ですね。
なお、Target trial emulationについては以下のkrskさんのブログをご参照ください。
次の項で、Active comparatorがどのようなメリットをもたらすのが、詳細に説明していきましょう。
Active comparatorのメリット
適応による交絡に対処することができる
適応による交絡(Bias by indication)とは、疫学研究の3大バイアスの一つ、交絡バイアスの一種です(残り2つは選択バイアス、情報バイアス)。
これは、ターゲット薬群と比較群において患者アウトカムを比較する際に、アウトカムに影響する疾患の有無、その重症度が両群でバランシングされていない際に生じるバイアスです。
もう少し具体的に説明していきましょう。
実臨床においては、薬剤は何らかの疾患を治療したり、予防するために使用されます。
何の理由もないのに副作用のリスクをとってまで薬剤を投与するということはあり得ませんので、当然と言えば当然の話ですね。
この際、それぞれの薬剤の投与目的である疾患を適応(indication)と呼びます。
例えば、抗がん剤であれば対象となる癌であり、インスリンであれば糖尿病などが適応になります。
この時、ターゲット薬と比較群において適応である疾患の有無、重症度に差があり、かつこの疾患の有無、もしくは重症度自体がアウトカムに影響を与えてしまうと、適応による交絡が生じることになります。

例えば、適応症として消化管出血があったとします。
そして、COX-2選択的阻害薬が消化管出血のリスクを軽減させるかどうかを調べるとしましょう。
この時、COX-2選択的阻害薬の投与群に対して、比較群にNon userを設定したとします。
すると、COX-2選択的阻害薬は適応症として消化管出血があり、そして消化管出血の既往歴は将来の消化管出血のリスクを増強させますので、COX-2選択的阻害薬は適応症である消化管出血が交絡となり、Non userに比べてCOX-2選択的阻害薬の投与群において見かけ上の消化管出血リスクが高くなってしまうというバイアスが生じますね。
つまり、Active userを用いないことで生じる適応による交絡とは、ターゲット薬のアウトカム発症リスクを増加させる(unfavorable to target drug)方向に働くバイアスです。
この時、Active comparatorを用いるとどうなるでしょうか?
Active comparatorとして、COX-2選択的阻害薬と同クラスの薬剤であり、かつ消化管出血を適応症に持つ薬剤Bを使用したとしましょう。
すると理想的な状況では、COX-2選択的阻害薬と薬剤Bの使用患者間では、適応症である消化管出血の有無、重症度が平均的に等しくなるために、上のDAGでは適応を交絡として開いていたback-door pathを閉じることができます。
さて、ここでとある研究を紹介しましょう。
Non userに比べて、Active comparatorを用いることで、どの程度適応による交絡に対処することができるかを調べた大変意義のある研究です1。
筆者らはMedicareデータベースにおける65歳以上の高齢者を対象に、スタチン投与と1年以内死亡の関連を調べました。
その際、患者集団を以下の方法で制限し、リスク比で測定されたスタチンの死亡抑制効果(点推定値および95%信頼区間)がどう変化するか観察しました。
下図は、最も小さい資格がemulateすべきRCTのデザインの患者集団であり、そこから四角が大きくなるほど、RCTの患者集団から離れていることを意味しています(余談ですが、この図めっちゃわかりやすいですよね)。
1bまではNon userとの比較であり、2からがActive comparatorとの比較ですね。
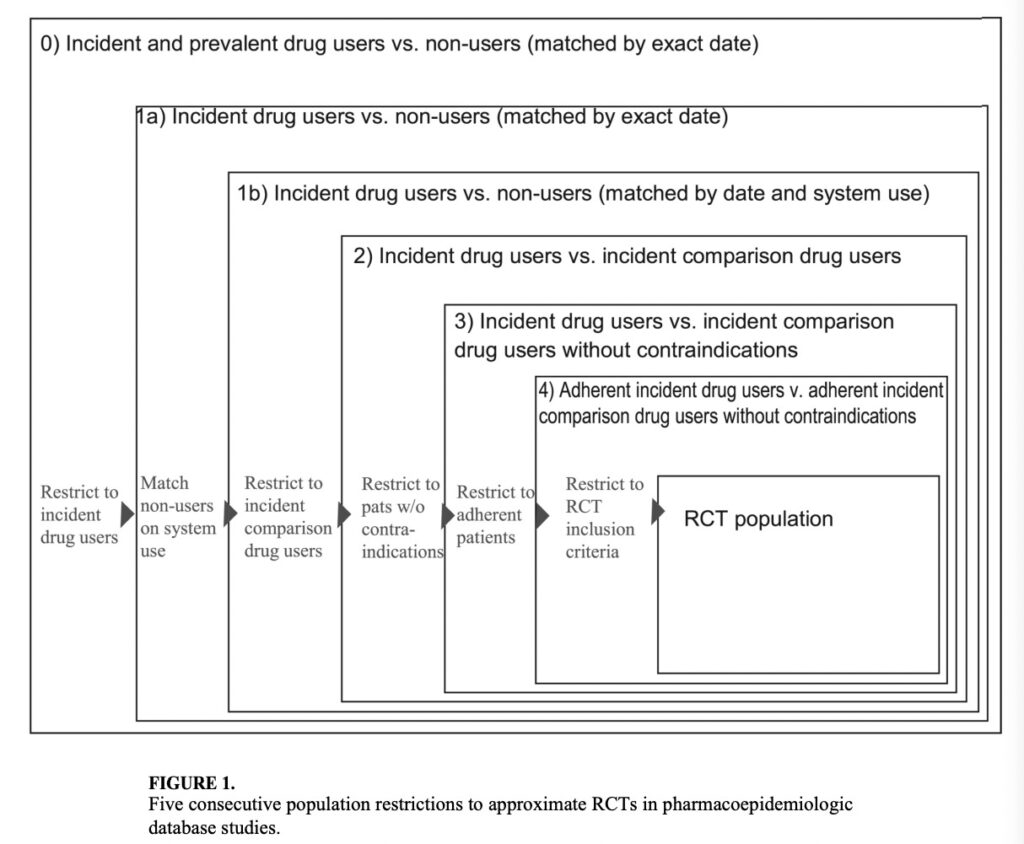
こちらは、それぞれの患者集団における調整済みリスク比を著しています。
その結果、筆者らが設定した患者集団がTarget trialであるRCTの患者集団に近づいていくにつれ、スタチンの死亡抑制に対するリスク比が増加していることが分かります(つまり、死亡抑制効果が低くなっている)。

ここで面白いのは、Non userに対してActive comparatorを設定した1b→2においてはリスク比が大きく変わっているのに対して、2→3、3→4というように、Active comparatorをさらに厳しく設定してRCTの患者集団に近づけたとしても、リスク比は大きく変化しなかったという点ですね。
なお、肝心のTarget trialであるRCTにおけるスタチンの死亡抑制に対するリスク比はどうだったのかというと、複数のメタ解析、RCTの中で、筆者らの患者集団と最も近しい条件を設定しているRCTにおいては、リスク比は0.78となり、筆者らが設定したコホート5と類似した結果となりました。
これをもって筆者らは、Active comparatorを用いることで、より適切にTarget trialをemulateすることができると結論しています。
では、なぜCohort 0に, 1a, 1bではTarget trialと乖離した結果になってしまったのでしょうか。
その最も大きな理由が、この項で説明しているスタチンの適用による交絡です。
筆者らはNon userとActive userのそれぞれを比較群として用いた際のスタチン群・比較群での患者背景のばらつきを観察しました。
すると、Non userを用いたコホート0に比較して、Active comparatorを用いたコホート3の方が、スタチン群・比較群間での冠状動脈性心疾患のリスク因子や循環器疾患の有病割合のばらつきが小さくなっていたのです(Active comparatorを用いることで、よりcomparableなコホートを形成できていた)。
つまり、Active comparatorを用いることで、スタチンの適応による交絡を削減することができていたということになります。
この論文のTable 1では、コホート定義を変えることで、患者の治療歴、既往歴、その他の患者背景などの分布がどう変化するかということが示されていますので、興味がある方はそちらもご覧になってみると、Non userとActive comparatorにおける患者背景の差異が良く分かって面白いと思います。
Healthy-initiator biasに対処することができる
Active comparatorを用いることのメリット2つ目です。
一つ目では、適応による交絡によって、Non userと比べてターゲット薬群の方にアウトカムのリスクである疾患を持つ患者、その疾患がより重症な患者が集まってしまい、unfavorable to target drugな方向にバイアスがかかってしまうとお話ししました。
しかしながら、スタチンの研究ではNon userを比較群に用いた場合のスタチンの抑制効果が、Active comparatorを比較群に用いた際よりも大きくなっています(リスク比が小さくなっている)。
スタチン vs Non userの比較では、スタチン群に冠状動脈性心疾患のリスク因子を持つ患者が多く集まっていた一方、スタチン vs Active comparatorでは、このリスク因子がよりバランシングされていましたので、適応による交絡だけが働いたのであれば、前者のリスク比は後者よりも大きくなるはずです(unfavorable to statinな方向へのバイアス)。
筆者らはこの点に関して説明してはいませんでしたが、その可能性としてはActive comparatorによって引き起こされる2つ目の交絡バイアスが影響していた可能性があります。
それが、Healthy-initiator biasです。
Healthy-initiator biasは、大きく2つの作用機序により発生します。
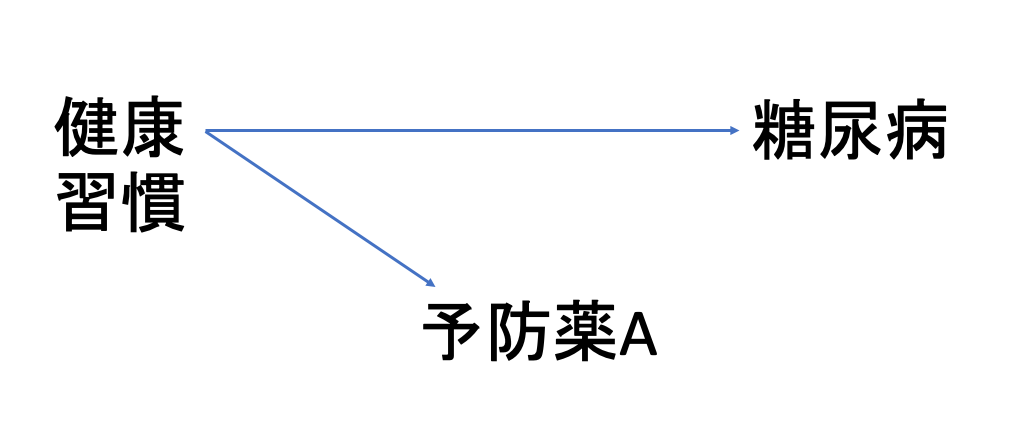
一つ目が、特にターゲット薬が何らかの疾患の予防薬である際に起こりうるバイアスです。
とある予防薬Aの使用群と、比較群であるNon userにおいて、予防薬の対象である糖尿病の発生リスクを比較したとしましょう。
この時、予防薬Aの使用群の患者には、積極的に予防薬を使用するような健康意識の高い患者が多く含まれていたと考えられます。
これにより、予防薬Aの使用群では、比較群のNon userと比較して、適切な食習慣・運動習慣、睡眠時間が維持されている可能性も高くなります。これらの生活習慣は、当然糖尿病の発症を抑制しますので、このような健康習慣がバイアスとなり、予防薬Aの使用群における見かけ上の糖尿病発症リスクが低くなってしまいます。
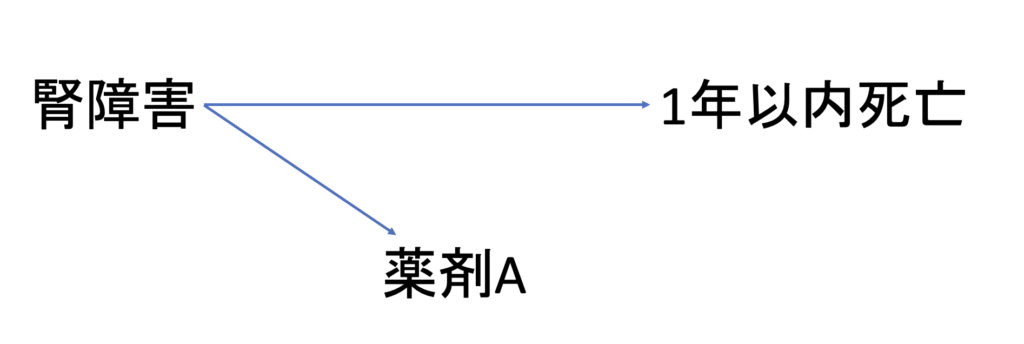
二つ目が、ターゲット薬が何らかの禁忌を有する際に起こりうるバイアスです。
例えば、薬剤Aは腎障害のある患者では使用不可だったとしましょう。
この時、薬剤Aの使用群と比較群のNon userの間で、1年以内死亡のリスクを比較したとします。
Non userの患者は、薬剤Aを使用できないほどの腎障害を有していた患者ですので、そもそもの患者背景として、Non userにおいて1年以内死亡リスクが高い患者が集まっていたと考えることができます。このように、ターゲット薬の禁忌がバイアスとなり、薬剤Aの使用群における見かけ上の1年以内死亡リスクが低くなってしまいます。
このように、Healthy-initiator biasでは、薬剤の投与を引き起こした患者の健康意識、そして禁忌が交絡となり、バイアスを引き起こしますが、Active comparatorを用いることで、2群間での健康意識、禁忌の分布をよりバランシングすることができるわけですね。
これが、Active comparatorのメリットの2つ目です。
臨床的に意義のあるリサーチクエスチョンに答えられる
上で述べてきたActive comparatorを用いる2つのメリットは、疫学的なバイアスという観点からのメリットでした。
最後のメリットは、臨床的な観点からのメリットになります。
お気づきの通り、Non userを用いたデザインと、Active comparatorを用いたデザインでは、そもそも答えているリサーチクエスチョンが全く異なります。
Non userの場合は、「薬剤の非使用者と比較した際の、薬剤Aの有効性・安全性」がリサーチクエスチョンであり、Active comparatorの場合は、「薬剤Bと比較した際の、薬剤Aの有効性・安全性」がリサーチクエスチョンです。
では、この2つのリサーチクエスチョンのうち、臨床的に意義の深いリサーチクエスチョンはどちらでしょうか?
私は後者だと思います。
なぜなら、薬剤Aは患者が投与を必要としているから投与するのであり、「薬剤Aを投与した時と、投与しなかった時、どちらが患者にとって良いだろうか」と意思決定を悩むようなシチュエーションはあまり登場しないと考えられるからです2。
薬剤Aを要する患者に対し、有効性・安全性の観点から悩むとしたら、それは「投与しなかった場合」ではなく、「薬剤Aと似たような薬として薬剤Bがあるけれど、どちらが有効性・安全性が高いのだろうか」という状況でしょう。
Active comparatorとして、薬剤Aと同じような状況で使われている薬剤Bを設定することで、実臨床における「薬剤Aと薬剤B、どっちが有効性・安全性が高いんだろう」という医療者の悩みに答えることができるわけですね。
これが、Active comparatorを用いるメリットの3つ目でした。
なお、詳しく説明されてはおりませんでしたが、本記事の執筆において参考にしている論文3では、Active comparatorを用いることで、交絡バイアスだけでなく、Selection biasやDetection biasをも軽減することができると記載されていました。
これは私の推測ですが、適応・禁忌が類似した同クラスの薬剤間では、薬剤の中断やスイッチ、診察頻度や医師の診察方法なども類似してくると考えられるからではないでしょうか。
Active comparatorの選択方法
さて、ここまではActive comparatorを用いるメリットについて解説してきました。
最後は、どのような基準でActive comparatorを選択すれば良いか説明しましょう。
Active comparatorを用いるメリットで説明した通り、Active comparatorはターゲット薬と適応・禁忌が類似した同クラスの薬剤から選ぶのがベストです。
そのため、Active comparatorを選ぶ上でまず参照すべきは、その薬剤に関する臨床ガイドラインです3。
例えば、とある癌の治療に使われる抗がん剤Aに対するActive comparatorを選ぶ際に、臨床ガイドラインが抗がん剤Aをステージ3の治療にのみ推奨しており、一方で抗がん剤Bをステージ3及び4の両方の治療で推奨していたとしたら、適応による違いが大きく、抗がん剤BはActive comparatorとしては不適切という判断を下すことができるでしょう。
次に確認すべきは、実際の薬剤AとActive comparatorの候補薬の使用者間での背景因子の分布です。
2群間での年齢や性別、既往歴、併用薬、その他患者背景の分布がより類似している薬剤ほど、「使用されている患者像が近しい」と言うことができるため、Active comparatorとして適切になるでしょう。
最後に、これは論文に書かれていることではなく、私個人が気をつけていることですが、実臨床の専門家の意見を参照することです。
私自身がターゲット薬に対するActive comparatorを選ぶ際には、必ずその薬剤に詳しい専門医にコンサルし、「このターゲット薬に対する比較薬として〜などを考えているが、これらの薬剤が投与される患者像は乖離してませんでしょうか?」といった形で助言を求めるようにしています。
実臨床は必ずしも臨床ガイドラインに沿っているとは限りませんし、また背景因子を確認するデータドリブンな方法では、データで採られた限られた背景因子しか確認できないという限界があります。
実際にその薬を日夜取り扱っている専門家こそが、「Active comparatorとして最も納得感のある薬剤はどれか」と言うことに対する答えを持っている方だと思うので、実臨床の専門家へのコンサルは必要不可欠でしょう。
終わりに
さて、いかがでしたでしょうか?
本記事では、
- Active comparatorとは何か
- Actice comparatorを用いるメリットについて
- Active comparatorの選択方法について
の3点をご紹介してきました。
Non user designと比較した際の、Active comparator designのメリットの大きさがお分かり頂けたかと思います。
余談ですが、東京大学の久保田潔先生が書かれた2013年の論文では、日本の製薬企業文化により、製薬企業が行う研究ではActive comparatorではなくNon userを用いる傾向にあるということが報告されていました4。
4 久保田潔. SS-MIXによる日本の薬剤疫学研究発展への期待. 薬剤疫学. 2013, 18(1), p41-48.
観察研究における薬の非使用者(治療を必要としない患者)は、治療される患者(治療が必要と判断され治療される患者)とは系統的に異なっており、また、その違いを特徴づけ、事後的に調整するために必要な情報が十分えられないことが多いため、両者の比較はバイアスを生じやすい。しかし、日本の企業文化では同系統の薬同士の比較を避けたいとの意識が根強く、自社製品使用者と非使用者の比較に傾きやすい。
こちらが書かれたのは約8年前であり、またGPSP省令改正によりデータベース調査が実施可能になる以前のことですので、現在もこのような企業文化が残っているかは私には分かりません。
しかしながら、仮にそのような企業文化がまだ残っているのだとしたら、薬剤の安全性は人の生き死にに直接的に関わることであり、それを明らかにするための研究が、暗黙の企業文化という非科学的な配慮により歪められてしまうことは、あってはならないことだと思います。
すきとほる疫学徒からのお願い
本ブログは、読者の方が自由に記事の金額を決められるPay What You Want方式を採用しています。
「勉強になった!」、「次も読みたい!」と本ブログに価値を感じてくださった場合は、以下のボタンをクリックし、ご自身が感じた価値に見合うだけの寄付を頂戴できますと幸いです。
もちろん価値を感じなかった方、また学生さんなど金銭的に厳しい状況にある方からのご寄付は不要です。
引き続き情報発信していく活力になりますので、ぜひお気持ちに反しない範囲でご寄付をお願い致します!








