こんな人におすすめの記事です。
- 薬剤の使用実態研究をこれからやろうと思っている
- 薬剤疫学をしているけれど、使用実態研究に自信がない
こんなお悩みを解決します。
この記事では薬剤疫学の専門家として外資製薬企業で働く私が、これまでに学んだ薬剤の使用実態研究の全てを可能な限り解説します。
ちなみにこのブログをお読みいただくと、100回は「めんどくさ」ってぼやきが出ると思いますが、安心してください、私も「めんどくさ」って思いながらいつも使用実態研究やってます。
「薬がどうやって使われてるか、ビッグデータで見てみよう」って言うじゃん、そんな簡単じゃないのよ!
本ブログは、私個人の責任で執筆され、所属する組織の見解を代表する物ではありません
薬剤の使用実態研究って何?

薬剤の使用実態研究(Drug utilization study)とはその名の通り、「薬が実社会でどのように使われているのかという実態を明らかにするための研究」です。
もっと堅苦しく表現すると、Pharmacoepidemiology and Therapeutic Risk Managementという参考書では、次のように定義されます。
Drug Utilization Research is an eclectic collection of descriptive and analytical methods for the quantification, the understanding and the evaluation of the processes of prescribing, dispensing and consumption of medicines, and for the testing of interventions to enhance the quality of these processes.
Pharmacoepidemiology and Therapeutic Risk Management
日本語に訳します。
薬剤の使用実態研究は、医薬品の処方、調剤、そして消費のプロセスを定量化、理解、評価するための、そしてこれらのプロセスの品質を向上するための介入を検証するための記述的で分析的な方法論の多様な集合体です。
疫学でいうと、記述、因果推論、予測という3つの大きなテーマのうち、記述に分類されます。
どうして薬剤の使用実態を見る必要があるんでしょう?
- 薬剤のマーケティングや将来の薬剤開発の基礎資料とするため
- 増加傾向にある薬剤への支出のモニタリングのため
- 薬剤が適正に使用されているかをモニタリングするため
あたりがメインの目的です。
実社会での薬の使われ方に着目しますので、昨今流行りの言葉を使えば”Real World Data”を用いた研究であり、そこから創出されるエビデンスは”Real World Evidence”となります。
薬剤の使用実態研究は、医療ビッグデータの活用可能性が広がるとともに急速に進歩してきました。
ですので、このブログでは「医療ビッグデータを用いた薬剤の使用実態研究」について、着目するアウトカム(使用実態)ごとに解説していきたいと思います。
Induction therapy(初回処方)
初回処方とは「ある疾患に診断された後に、その治療のために最初に処方される薬剤」を指します。
初回処方をアウトカムにした研究のアウトプットの一例はこちら。結核と診断された患者が診断から2ヶ月以内に処方された薬剤の頻度を算出しています。
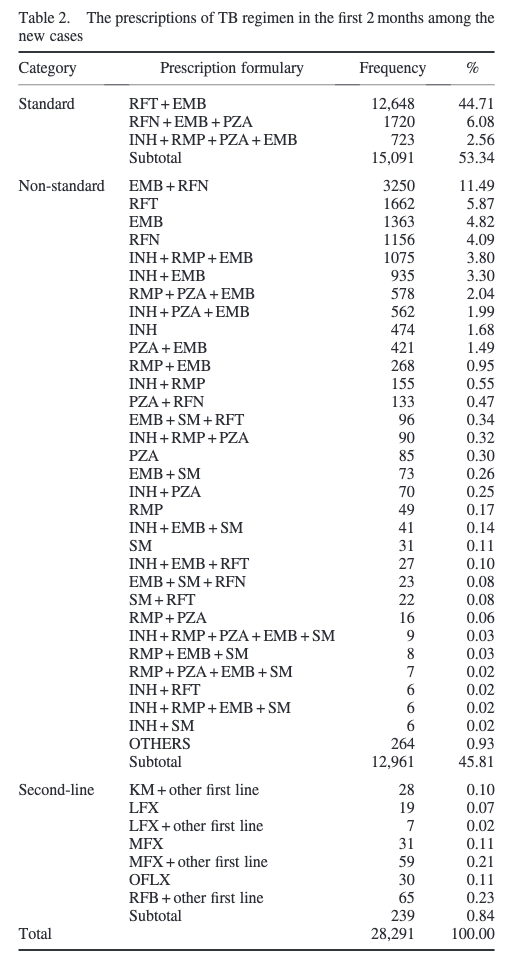
さて、なぜこのチャプターはあえて初回処方に限定して解説をするのか?
それは医療ビッグデータを用いた研究では、初回以降の処方を定義するのは死ぬほど難しいからです(特に抗がん剤のようにラインごとに治療が切り替わり、併用療法がバンバン出てくるような薬剤では)。。。
その難しさ、方法は別のチャプターで解説しますので、まずは初回処方の解析方法について学んでいきましょう。
Index dateの設定
Index dateとは日本語で「起点となる日」を意味します。なぜIndex dateの設定が必要かというと、「Index date以降で初めて処方された薬剤を初回処方の薬剤」と定義するからですね。
通常は着目する疾患の初回の確定診断日をIndex dateとします。
方法はこんな感じ。
- 疾患定義を作成する(病名、検査、薬剤投与などを組み合わせ)
- 疾患定義により設定されたIndex dateより過去Xヶ月のデータを見て、過去のその病名が付与されていないことを確認する(Wash-out periodと言います)
ようは「疾患の発症時点を見つけて、過去を振り返ってその病名がなければ、まぁそれが新規発症者としても良いでしょう」という考えですね(データソースが施設間の結合ができるものか、施設単体のものかでここの考え方は変わりますが、今回の主題ではないので触れません)。
だから、新規発症者の定義には「過去Xヶ月」のデータが取れていることが前提になるよ
こうして定義された新規の薬剤使用者をNew-userと呼びます。反対に、既存の使用者はPrevalent-user。実はこの違い、薬剤の有効性・安全性を比較するときには超絶大切です。そこら辺はこの記事で解説しています。
こんにちは、すきとほる疫学徒です。 本日は、薬剤疫学分野で観察研究を行う際に注意しなければならないバイアス、Prevalent user biasを取り上げ、その理論的背景、具体例、そして対処法について解説していきたいと思[…]
さて、話を初回処方に戻しましょう。
上でお伝えしたプロセスを実際に行なっているのがこちら(冒頭で引用したFigureの元論文の患者選択のプロセスです)。
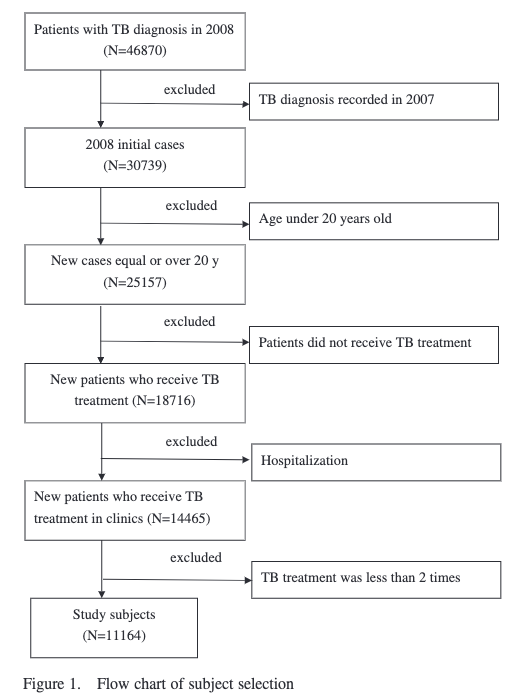
ご覧の通り、
- 1段目で「2008年に結核病名がある患者を特定し」
- 2段目で「2008年より前に結核病名がある患者を除外」
していることが分かります。
なお、Index dateですが「初回の確定診断日とするか、確定診断に必要な検査日とするか、それとも治療に必要な薬剤の初回処方日とするか」で幾つかのパターンが存在します。
基本は初回の確定診断日として良いと思いますが、医療ビッグデータの病名情報というのは本当に信用ならないので、「この病名がつく前もしくはつけば必ずその日のうちにこの検査・薬剤を提供する」という医療行為があるのであれば、そちらの日をIndex dateにした方が良いかもしれません。
ちなみに「なぜ医療ビッグデータの病名を信用してはいけないのか」ということはこちらの記事で解説しています。
こんな人におすすめの記事です。 レセプトデータベースを使った疫学研究をやってみたい Real World Dataに関わる仕事に携わりはじめたけど、やり方がわからない 「レセプト病名の信頼性」に関して何の疑いも持たずに[…]
初回処方の特定
さて、Index dateが特定できたら、次は初回処方を特定します(Index prescriptionとか呼びます)。
シンプルに言えば「Index dateから一番近い処方をとれば良い」ということになるのですが、ここで2つ考えねばなりません。
- 併用療法はどう扱うのか
- Index dateから何ヶ月までを「初回」と定義するのか
併用療法の定義は非常に複雑なので、次のチャプターで解説します。
なのでここで考えたいのは「Index dateから何ヶ月までを”初回”とするのか」ということですね。
たとえば「この疾患になれば必ず2ヶ月以内に薬剤を投与せねばならない」という疾患であればそう難しくありません、”2ヶ月以内”で良いでしょう。
先ほどの結核の論文もガイドラインを参考にIndex dateから2ヶ月以内を初回処方と定義しています。

問題は「この疾患になっても薬剤を投与する場合もあれば、しない場合もある」という疾患です。
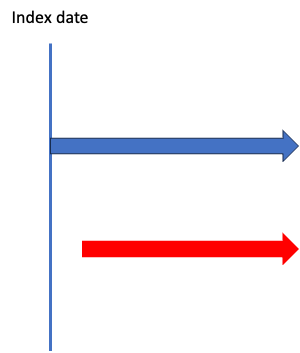
このように、青さんはIndex dateと同日に初回処方を受け、赤さんは1年後に初回処方を受けたとします。
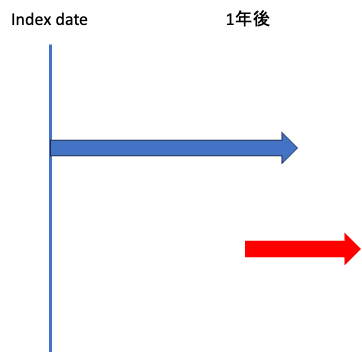
これ、赤さんの1年後の投与って本当に初回処方ですかね?
疾患にもよりますが、赤さんの初回処方は「処方薬なし」とするのが正しく、1年後の処方は「処方薬なしで経過観察してきたが、疾患が悪化したために投薬治療をすることにした」という理由で生じたものでしょう。
ですから、このような疾患を対象に初回処方を見る際には「Index dateからXヶ月以内に処方が始まらなければ、それは”初回処方なし”とする」という定義を作成せねばなりません。
専門医やガイドラインを参考にして定義しましょう。
”初回処方”まとめ
- まずは疾患の診断日を特定してIndex dateを定義しよう
- Index dateからXヶ月以内の処方を”初回処方”と定義しよう
Combination Therapy(併用療法)
さて、ここから一気に難易度があがります。
私も薬剤疫学には数年間、毎日携わっていますが、併用療法の定義にはいまだに頭を悩まされています。。。
一緒に使われてる薬を見つければいいだけでしょ?
ほう…それはどうやって?
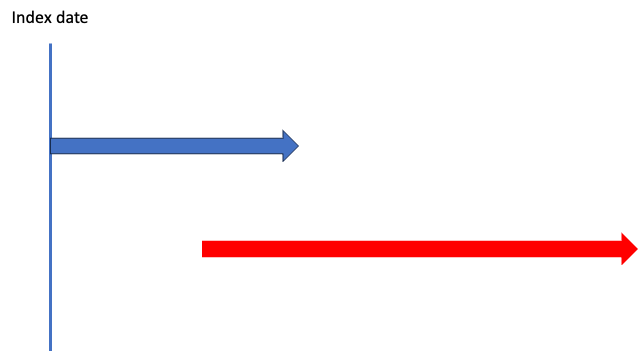
だから、同じ日に処方とか!
こういうこと?
そうそう!
じゃあこれは?
こっ…これもほぼ被ってるから併用!
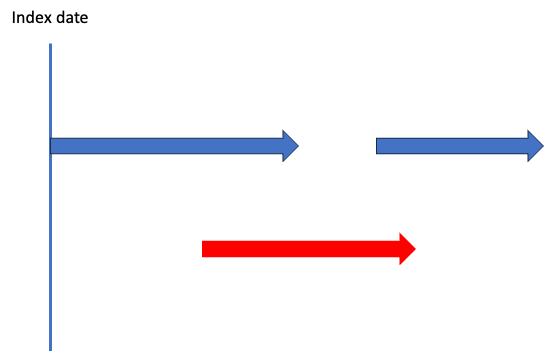
ほう、これは?
これは?
これは?
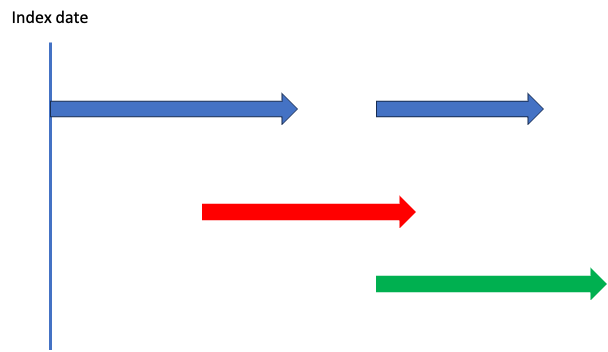
わァっ…わァ…
という感じで、医療ビッグデータ、特にレセプトデータから併用両方を定義するのはめちゃくちゃ難しいんです。
電子カルテに「薬剤Aと薬剤Bを併用で投与」と医師指示が書いてあるならまだしも、レセプトから分かるのは薬剤名、処方日、処方期間、処方量だけですから。この情報から「併用療法」を定義するアルゴリズムを作らねばなりません。
そして、そのアルゴリズムで作られた定義が実際の併用療法を100%正しく判定することは不可能です。つまり、薬剤使用実態研究における併用療法とはそれほどまでに脆弱な妥当性の上に成り立って算出される結果だと認識しておかねばなりません。
ではその脆弱性を抱えつつも、どのようにベターなアルゴリズムを作れるのか考えていきましょう。
実臨床でありうる併用療法のパターンを確認する
まず、ガイドラインなどを参考に「起こりうる併用療法としてどんなものがあるのか」ということを確認します。
さすがに事前に併用療法の候補を考えずにゼロベースで「処方日数がX日被っていたら併用とみなす」として処方日・処方期間だけに頼った定義をすると、ほぼ実臨床ではありえないような組み合わせまで生まれてしまいますから(たとえば、A薬とB薬は絶対に併用しないが、A薬を1ヶ月分だして副作用が強かったので1週間で中止し、そこでB薬を1ヶ月分だしたとすると、レセプト上はA薬・B薬が23日間はオーバーラップしていたことになります)。
たとえば以下はⅣ期の小細胞肺癌のEGFR遺伝子変異陽性の際の治療アルゴリズムです。
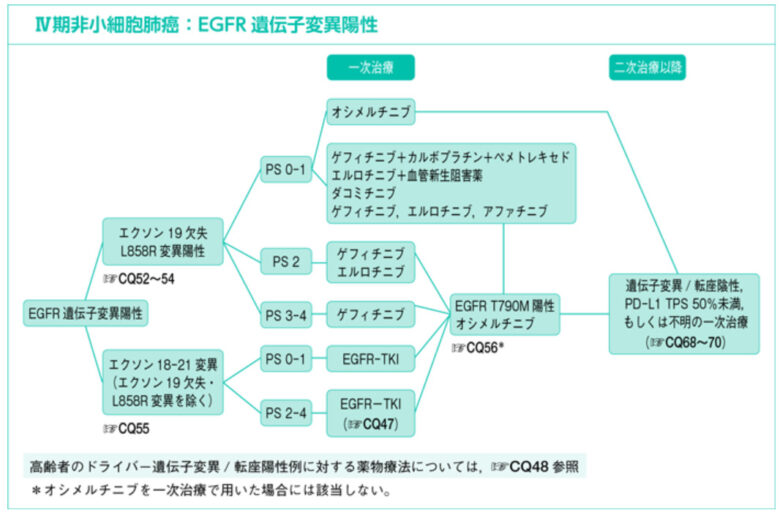
個人的には、ある程度併用療法が確立されている疾患を対象にする際は、「ガイドラインで推奨される組み合わせだけを併用療法として定義する」と事前規定した方が誤測定のリスクは下がると思います。一方で、「ガイドラインの遵守状況を確認する」といったようにガイドライン推奨外の併用療法もターゲットにせねばならない研究の場合はこの方法は使えません。
ちなみに先ほどの結核の研究でもガイドラインに則ってありうる併用療法を”standard prescriptions”として事前規定しています。

なお、この際に以下も専門医に確認しましょう。
- 併用療法を始める際、処方日をズラして併用することはありえるか
- ズレがあるとしたら何日程度が通常か
- 一回処方あたりの処方日数はどのくらいか
併用療法の定義①:1日でも重複あり
最もシンプルな方法ですね。
処方日や同時処方期間は問わず、併用療法の組み合わせとなる薬剤の処方期間が1日でもオーバーラップしていれば併用療法とみなすという方法です。
楽です、圧倒的に楽。
デザイン組むのも、計画書書くのも、そしてコーディングも全てが楽。
それやってる研究がこちらの肺高血圧症薬の使用実態研究です。

私は肺高血圧症の専門家ではないので、この分野ならば「1日でもオーバーラップすれば併用治療」とされるのかもしれませんが、これが全ての分野に当てはまるとは限りません。
たとえば、以下のように「実態は薬剤Aから薬剤BへのSwitching」の際、この定義を用いると薬剤A・薬剤Bが併用療法として誤って定義されてしまいます。

実臨床においては「前薬が残っているけれど、切り替え先の次薬を出す」なんてザラにありますので、この「1日でもオーバーラップがあれば併用療法」はあまり使える状況が多くなさそうです。
併用療法の定義②:同時処方日数がX日以上
これは①の定義の拡張版で、1日ではなくX日以上のオーバーラップが必要となります。
その定義を使っているのが、こちらのCNS系の薬剤の使用実態研究。

「60日以上の処方期間のオーバーラップがあれば併用とみなす」と定義していますね。
これなら①で問題になっていた「Switchingの際のわずかなオーバーラップも併用と定義してしまう」がクリアできそうです。
ただし、「処方期間」という概念が登場することで新たな問題が生じます。
それは「継続した処方期間をどう定義するのか」という問題です(例えばX回目とX+1回目の処方の間が何日空いていれば処方継続・中断と定義するか)。ここもまた複雑な思考が必要になるので、別のチャプターで解説します。
また、処方期間を見てもどうしてもクリアできない問題があり、それは「処方はしたけど中止して、結局は内服しなかった」という薬剤を除外できないということです。
たとえばこの場合。

これ、一見すると青薬と赤薬が併用されているようですが、もしかしたら「青薬を出したけど、副作用が強かったのでさっさと赤薬に変更した」場合もあり得ますよね?
しかし、残念ながらレセプトデータで追跡できるのは処方(もしくは調剤)のみであり、その薬剤が実際に内服されたかどうかは不明です。
併用両方の定義③:リフィルがX回以上
②の方法のリミテーションは「Switchingにともない生じていたオーバーラップも併用療法と定義してしまう」ということでした。
この問題に対処するために開発されたのがRefill pattern methodです。
端的にいうと「オーバーラップしてからも何回か処方されてたら、そりゃSwitchingではないっしょ(Switchingならそれ以降の処方は止まるはず)」という考えのもと、「複数回の処方」を条件に併用療法を定義する方法です。
もともとはポリファーマシーを適切に定量化するために開発されました(ポリファーマシーって複数の薬剤の併用によって生じる問題だから)。
ほんっといろんな方法考えるよねー
オリジナルの論文の記載はこちら。

イラストにするとこちら(同論文から引用)
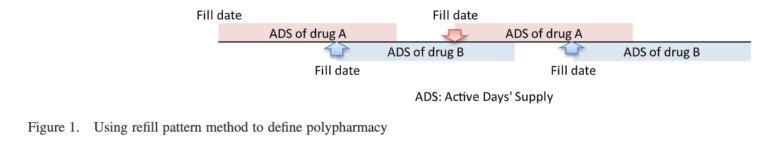
これまで紹介した方法であれば、初回のDrug Bの処方が発生した時点で併用療法と定義していましたが、Refill pattern methodではその後にDrug A、そして再びDrug Bの処方がきて初めて併用療法と定義されます(つまり、併用療法の定義に合計4回の処方イベントが必要)。
こちらは赤薬→青薬へのSwitchingを描いたグラフですが、通常のオーバーラップによる定義だと併用療法として定義される赤薬・青薬も、Refill pattern methodであれば併用療法とは定義されません(青薬の後に赤薬の再処方がないから)。

さらにこの論文、Refill pattern methodとTraditional method(オーバーラップX日以上)で併用療法の有無がどう変わるかを実際に解析しています。
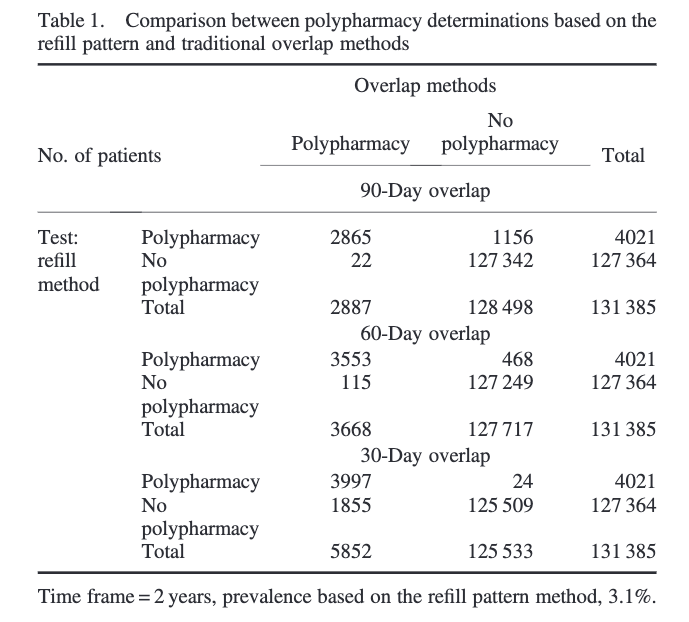
ご覧の通り、Refill methodの方が厳しい定義(特異度が高い)を用いているため、ポリファーマシーと定義されるエピソード数が少なくなっています。
これまで紹介した①と②の方法に比べると、より妥当な定義に思えます。
しかし、この方法には次のようなリミテーションも。
- 3剤以上の併用療法の定義になると非常に複雑になる(論文では薬剤A・Bが併用両方の定義を満たす際、薬剤CがA・Bのいずれかと併用両方の定義を満たせば3剤併用と定義すると解説)
- 2剤に対して合計4回の処方が定義に必要となるので、追跡期間が短い場合は併用療法を過小報告するかもしれない(論文の報告では1年で十分だったとのこと)
- 一方の薬剤がもう片方の薬剤の処方期間中のみに処方される場合、正しく併用療法が定義できない(以下の図を参照)

上の図では薬剤Aの処方は全て薬剤Bの処方期間中のみに行われていることが分かります。この場合、Refill methodの定義に必要な「薬剤Aの処方期間中に薬剤Bが処方」というイベント2回が追えません。これは併用を定義する2剤の処方期間がそれぞれ長い(Drug B)・短い(Drug A)もので組み合わされていると生じやすくなります。
Treatment Line(治療ライン)
「治療ラインがみたいです」
これも相談者様からよく頂く依頼ですが、併用療法と同じように複雑な定義が必要です。
これまでみていた初回治療と併用療法はいわば点、「ある時点における薬剤使用実態」の定量化です。
ここから先はその点を横に動かし、時間という概念を加えます。
ラインなんて左から順番に決めてけばいいだろ?
スッ
わァっ…わァ…
そうです、併用療法と同じように、当然ながらレセプトデータには「これが2次ラインの治療です」なんてことは書いてないので、自力でラインを定義するアルゴリズムを作らねばなりません。
なお、治療ラインの定義の妥当性は私個人としてはかなり怪しいと思っており、現実と乖離した結果となる可能性が高いため、あまりアウトカムとしては算出しない方が良いと思っています。
私も依頼された時には基本はお断りしています。
治療ラインのシンプルな定義
治療ラインの変更を生じさせるのは以下の2つのイベントのいずれかです。
- Add-on:前治療を継続して新たな薬剤の追加
- Switching:前治療を中断して新たな薬剤に切り替え
ですから、この双方を定義してやれば治療ラインの定義ができることになります。
それをシンプルにやってるのはこちらの研究で、糖尿病治療薬の使用実態を記述しています。

- Add-on:前薬が継続しており、次の薬が21日以上それに被る形で処方されている
- Switching:前薬が中断し、さらに前薬の処方期間平均の1.5倍以上の期間(Grace period)内に次の薬が処方されている
なお、Swichingで使われるGrace periodとは”猶予期間”と呼ばれ、前薬の飲み忘れや効果の残存などを加味し、「前薬の影響が残存していると仮定して継続を猶予する期間」のことです。
上記の2定義はかなりシンプルですが、それ故に粗が目立ちます。
たとえば、「21日以上継続していればAdd-on」という定義ですが、この定義を使うと以下の図の右も左も赤薬が追加された時点で「初回治療からのAdd-on」として2次ラインに変更があったと判断されます。
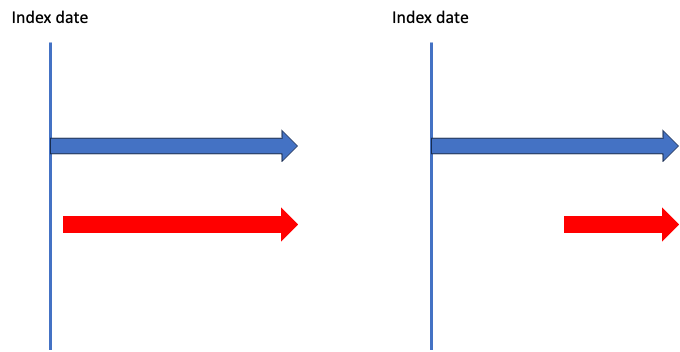
これ微妙ですよね?
右図に関しては確かに青薬が使われてある程度経ってから赤薬が使われているので、「別の治療戦略にスイッチした」と言って良いかもしれません。
一方で左図は、青薬が使われて次の日には赤薬が使われており、「別の治療戦略にスイッチした」というよりかは「もともと併用療法として青薬・赤薬を処方する予定であり、初回治療である」と言った方が良さそうです。
このように処方時点を決めずにシンプルに「X日以上のオーバーラップがあればAdd-onとして治療ラインが移ったとする」としてしまうと、ちょっと都合が悪そうです。
余談ですが、「Add-onとSwtichingをどう区別するか」ということにも議論がありまして、以下の論文の方法が私の知る限りではベターなものです(泥沼にハマるので今は読まなくて良いです)。

治療ラインのちょっと複雑な定義
さて、先に紹介した定義よりも少し複雑になりますが、処方時点を加味した定義がこちらです。
多発性骨髄腫の抗がん剤の治療ラインを定めています。

3つの条件を定めています。
- 前治療から28日以上おいて次の薬が始まったらそれは別ライン(ただし、次の薬が前治療と同じ場合は同一ライン)
- それ以降も28日以上あいて異なる薬が処方されたらそれは別ライン
- 同一ラインのいずれかの薬剤が処方中断されても、それは同一ラインの継続とする
ですね。
ちなみに28日というのはあくまでも上記の多発性骨髄腫のケースですので、適切なGap periodは対象疾患ごとに決めねばなりません。
この定義はいわば「同一ラインなら処方日がX日以内にくるっしょ」という仮定に基づいた処方ラインの定義です。
逆に、X日以上のズレがあれば別ラインとするということになりますが、これは例えば抗がん剤のガイドラインを参考に「ライン間はX日間をあける」などの推奨があれば、それを参考に決めても良いでしょう。
Persistency(継続処方)
さて、これまで使用実態の解説をする中で矢印のイラストを用いてきました。
その矢印は「継続してその薬剤が処方されている期間」ですね。
ではこの期間、どう定義しますか?
処方日から処方日数の終わりまでじゃないの?
それだと1回分の処方しか追跡できないよ?
2回処方されてたら、1回目の処方日から2回目の処方日数の終わりまでくっつける
じゃあ1回目の処方日数の終わりと2回目の処方日が1年離れてたら?
わぁ…じゃあその間が2ヶ月以内なら継続にする
2ヶ月ってどう決めたの?根拠は?ほんとにそれでいいの?
わァっ…わァ…
継続処方のシンプルな定義
まずはX日以上と特定の期間が空いたら中断とする定義。
ちなみに継続処方は初回処方を測定するのが通常で、それ以降を見ることはほぼありません。
こちらの肺高血圧症治療薬の使用実態研究では処方期間の終了時点から90日を中断定義としています。

イラストにするとこうですね。
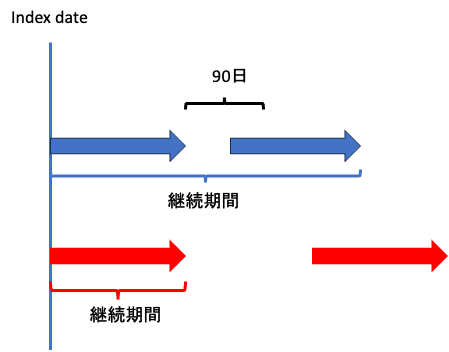
この方法にはシンプルが故の欠点があり、それは「薬剤ごとの許容できるGrace periodの差異を加味できない」という点。
Grace periodとは猶予期間のことであり、飲み忘れや残存効果を考えて「この期間は処方出てないけど、処方継続と考えて良いよ」という期間でしたね。
このGrace period、薬剤のクラスが違えば大きく変わる可能性があることは臨床の方であれば想像に難くないはずです。
とすると、全ての薬剤クラスに一律X日という定義をあてはめると、実際の処方継続の実態とは乖離した定義となってしまう可能性があります。
このようなシンプルな方法を用いる際には、最低でも感度分析で他のカットオフを設定し、結果に一貫性があるかどうかを確認すべきでしょう。こちらは脂質低下薬の継続処方の定義において、主解析で180日と設定したのに対し、感度分析で90日・135日を設定しています。

また、加えて明記せねばならないこととして、他剤がAdd-onされたらどうするのかということがあります。
その場合の選択肢は2つで、①Induction drug自体は変わらず処方されているので処方継続とする、②併用療法に移行したとして処方中断とするです。
こちらは高脂血症治療薬の使用実態研究ですが、「Add-onも処方継続にするよー」と明記しています(ちなみにこの研究もちゃんとGap periodに対して感度分析してますね)。

さらにもう一つ(こんな感じで明記しないといけないことがいっぱいあんのよ、全部の場合わけに対して対処法を事前規定しないといけないので)。
同クラスの薬剤へのSwitchingは処方継続とするか、中断とするかを明記せねばなりません。
もしクラス全体の処方継続を見たい場合にはそのまま継続、個別の薬剤ごとの処方継続を見たい場合には中断ですね。
ちなみに先ほど紹介した論文では「同クラスでみるよ」と明記されています。

継続処方の複雑な定義
より複雑な方法としては以下の2つがあります。
- 薬剤ごとに異なる固定のGap periodを与える
- 処方期間をベースにGap periodを推計する
先に紹介した「全ての薬剤に同一のGap periodを与える」方法を加えて、3種類の継続処方の定義を提供し、結果を比較しているのがこちらの研究です。
乾癬の治療薬の使用実態研究です。

- ある薬剤には150日を、それ以外には90日を適用
- 一律120日を適用
- 個々の薬剤の処方期間の2倍の期間を適用
最後の方法が面白いですね。
たまに目にしますが、「個々の薬剤ごとに全ての処方期間の平均、または最新の処方の処方期間をターゲットにし、それのX倍をGap periodとする」方法です(後者はコーディングがエグそうだな…)。
処方期間が短ければGap periodも短く、長ければ長くと、より実臨床を反映した定義が作成できそうです。
継続処方の提示
さて、こうして定義された継続処方ですがアウトカムの提示方法は何通りかあります。
- 継続処方の日数
- Xヶ月(ex. 半年、1年)を継続処方された患者割合
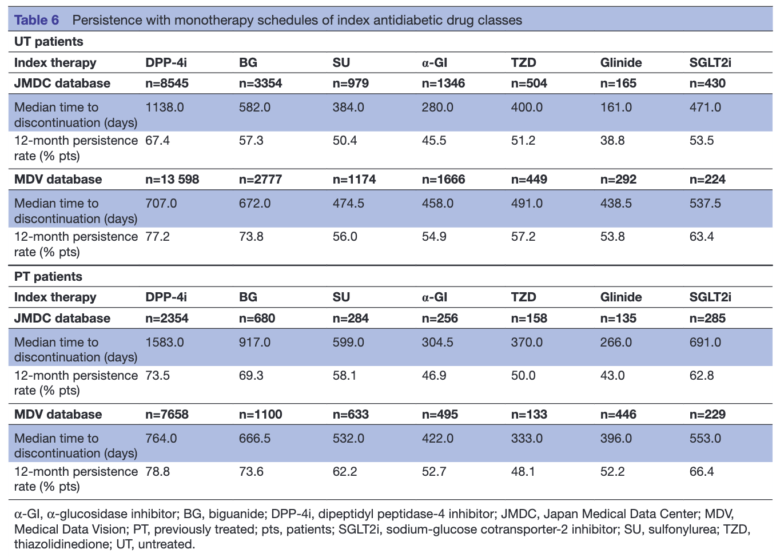
その双方を計算しているのがこちらの2型糖尿病治療薬の使用実態研究。

結果はこのように表示されます。
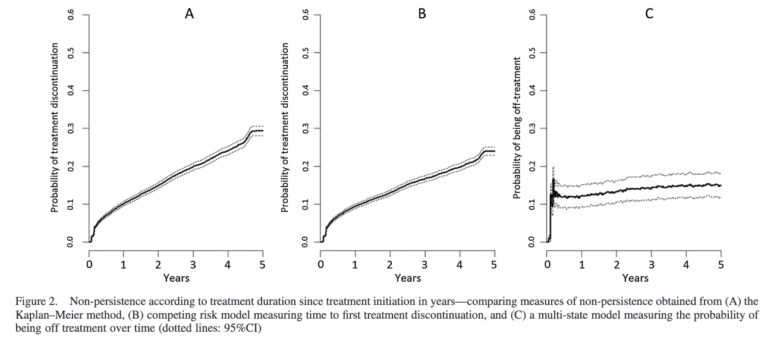
また、このように生存曲線を描くことも多いです。
以上で継続処方についての解説は終了です。
こちらの記事でも詳細に解説していますので、あわせてどうぞ。
こんにちは、すきとほる疫学徒です。 ここからしばらくは、薬剤疫学の曝露定義について一連の記事を書いていく予定です。 個人的には、2次的RWDを用いた薬剤疫学研究において、最も厄介なのがこの曝露定義だと思っています。 […]
なお、継続処方と類似の概念としてアドヒアランスがありますが、計算方法は全く異なります。
詳細はこちら。
こんにちは、すきとほる疫学徒です。 先日公開した薬剤曝露シリーズ②では、Persistenceについて取り上げました。 本日は、Persistenceとよく似た定義であるAdherenceについて取り上げようと思いま[…]
Treatment Journey(処方ジャーニー)
さて、継続処方と治療ラインの定義について学んだところで、さらに視野を横に広げます。
それが処方ジャーニー、治療歴がどのように推移していったかというアウトカムです。
抗がん剤のように治療ラインに関心がある場合には、それぞれのラインにおける処方を明らかにし、それを横に並べる形で処方ジャーニーを図示します(1st line, 2nd line, 3rd line, 4th lineを並べる)。
こちらは治療ラインの定義を援用すれば良いので、新たに解説はしません。
さて、ここで紹介したいのは「治療ラインではなく、特定時点での処方を反映させた処方ジャーニー」です。
何を言っているか分からないと思いますので、具体的にみてみましょう。
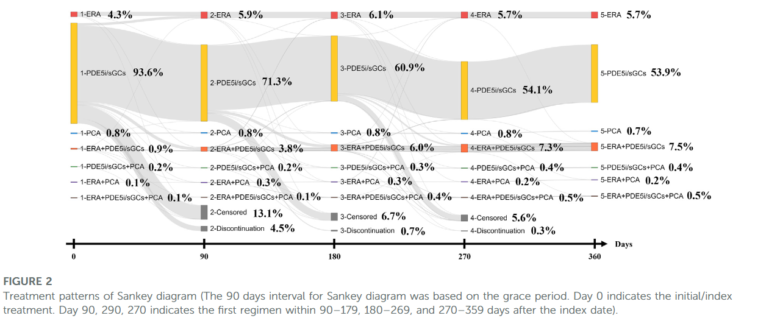
こんな感じで、横軸が0日、90日、180日、270日、360日と特定時点での処方をプロットしていることが分かりますね。
ちなみに上の図はSankey diagramと呼ばれ、処方ジャーニーを視覚化される際によく用いられる図です。
描き方を解説します。
- 処方薬を拾う特定の時点を決める
- その時点で使われている薬剤を拾う
- それをプロットする
簡単じゃん
まぁ待て、こっからだ
Sankey diagramの描き方
決めるべきは以下。
- 何日おきに時点を設定するか
- 何日まで追跡するか
- Allowance gapをどうするか
- 併用療法をどう扱うか
さて処方薬剤を調査する時点、何日おきにしましょう(上の引用文献では90日おきでした)?
原理原則を言えば「その疾患の治療において処方の変更が起こりうる期間ごとに」が正解です。処方サイクルが短ければ30日おきに別の薬剤を処方することもあれば、処方サイクルが長ければ90日おきの処方となるかもしれません。
ここは専門医に相談の上、実臨床のプラクティスを反映できる設定にしましょう。
次は何日まで追跡するかですが、実現可能性を考慮しなければ「長ければ長い方が良い」ということになるでしょう。しかしながら、そのためには「患者が最新の処方まで追跡し続けられている」という強い仮説が必要になります。
現実はそうではないので、追跡期間を伸ばせば伸ばすほど、後半は患者の欠損が大きくなっていきます。
これにより、後半のデータはサンプルサイズが少なく、また「何らかの理由で追跡できた特別な患者」に限られてしまい、結果の内的妥当性・外的妥当性が低下している恐れがあります。
なので、まずは対象とする患者の平均追跡期間を算出し、その数字と相談しながら追跡期間を決めましょう。
次にAllowance gapを設定します(めんどくさいですよね、安心してください私もめんどくさいです)。
Allowance gapとは「処方期間が特定時点から前後X日離れていても、それは特定時点で処方されていたものとみなしてカウントしまうよ」という期間です。
具体的に説明しましょう。
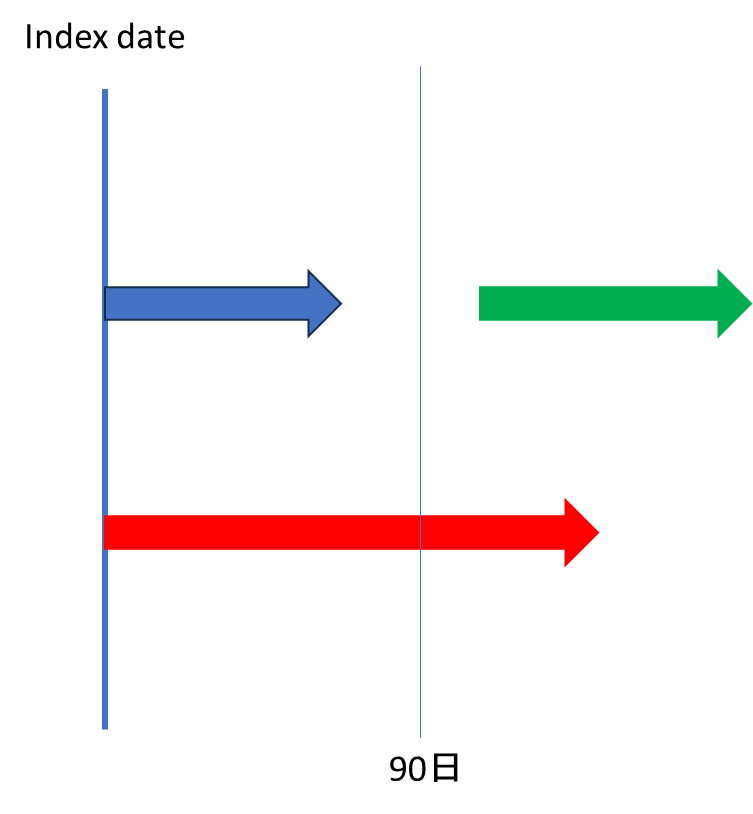
上の図、赤薬は90日時点に処方期間が被っているので、問題なく「90日時点で処方あり」と定義できますよね。
では、青薬と緑薬についてはどうですか?これ、90日時点はどちらの処方期間にもかぶっていないんので、仮に90日時点のみをピンポイントで見ていれば「処方薬なし」と定義されます。
でもこれっておかしいですよね?
90日時点は偶然処方のSwitchingにぶつかっただけで、これを「何の薬も処方されていなかった人」と同様に扱うと、現実と乖離してしまいます。これを回避するための手段がAllowance gapです。
たとえば、この黒矢印のように90日に±15日のAllowance gapを定めてやれば、緑薬が90日時点の処方薬としてカウントされます。
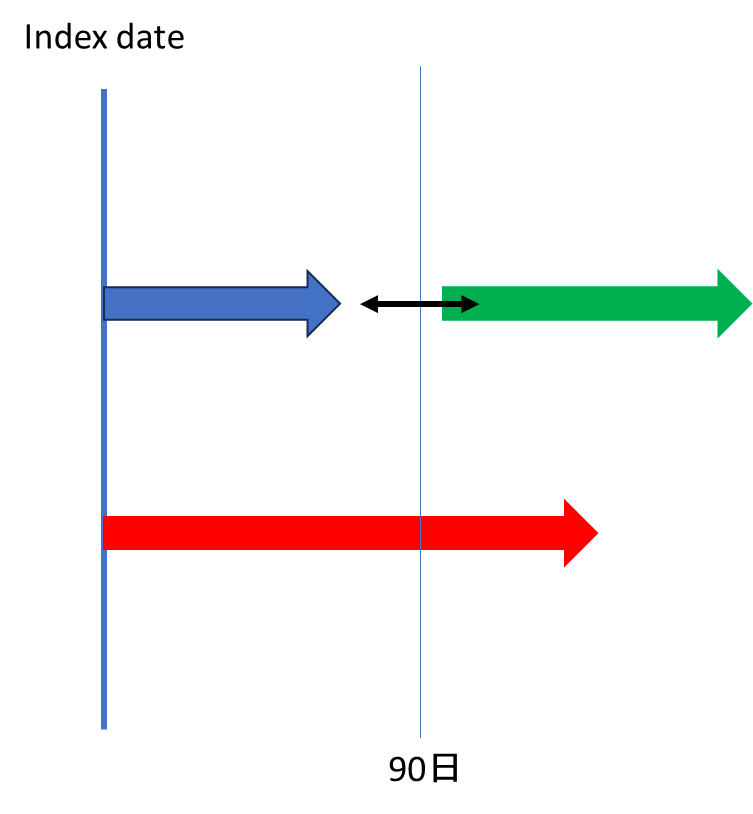
なお、さらに突っ込むとAllowance gapにSwitching前後の2剤(併用療法の場合はそれ以上)が該当したらどうするのか?と言うことも考えねばなりません。
個人的には「Allowance gapは次の薬への切り替えを進めている期間」と考えるとSwitching先の薬剤を拾った方が正しいと感じていますが、ここは先行研究での妥当性検証も見つけられていないので、あくまでも私の所感です。
最後に考えるべきは、併用療法をどう扱うかです(安心してください、私もめんどくさいです)。
併用療法を定義する場合は、既に説明した定義に則って行えばよいと思いますが、となるとかなりコーディングが複雑になります。
ですから私は、「抗がん剤のように併用療法を見ることに特に強い意味がある」状況でなければ、併用療法は定義せずに、全ての薬剤を個別にカウントするのが良いのではないかと思っています(90日時点でA+Bの両方であれば、そのそれぞれが処方されたとカウントする)。
そもそも併用療法の定義自体がかなり脆弱性があるので、これ以上脆弱性を重ねて解釈困難な定義を作るよりは、シンプルに個別薬剤でのカウントとした方が良いのではないでしょうか?
Saneky diagramのリミテーション
さて、ここまで説明して何ですが、私は個人的にはSankey diagramはお勧めしていません。
なぜなら、「Sankey diagramは特定の時点における処方の有無だけを見ており、真に薬剤処方の推移をみているわけではないから」です。
たとえば、以下の図を見てください。
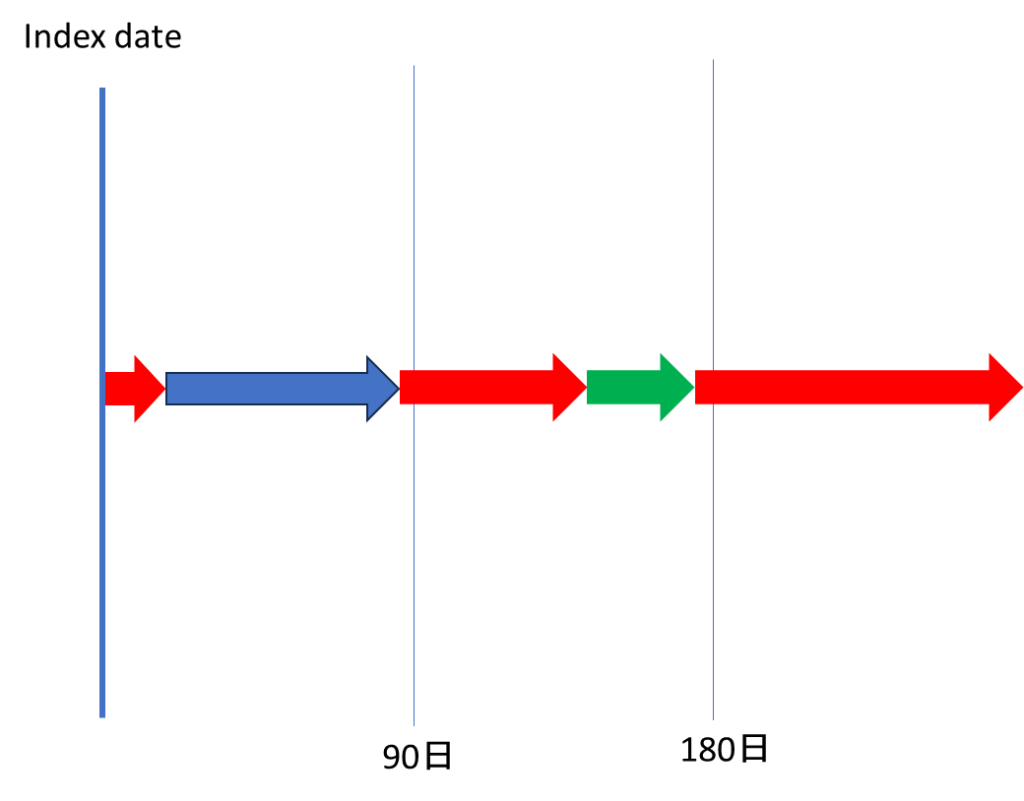
これ、Sankey diagram上は「90日も180日も薬をずっと処方されていた」としか見れません。
特定時点の間で起こったAdd-onやSwitchingは全て「なかったこと」にされてしまうんですよね。
これ、ぜんぜん現実を反映してないですよね?
このように、Sankey diagramには現実と大きく乖離した結果を提示する恐れがあり、読者のミスリーディングに繋がります。
ですから私は「Sankey diagramは基本は出すべきではない」と思っています。
Sankey diagramって「それっぽいことしてる」風に見えるので、疫学専門家以外の人からは「あれ出してよ」って言われることは珍しくありません。しかし、このように非常に強い脆弱性を抱えたアウトプットになるので、そこは勇気を出してNoと言う必要があると思います。
終わりに
以上で終了です。
以下の定義方法をお伝えしました。
- 初回処方
- 併用療法
- 治療ライン
- 処方継続
- 処方ジャーニー
「めんどくさ」って1000000回くらい聞こえてきた気がしますが、安心してください、私もいつも「めんどくさ」って思いながら研究デザインを組んでいます。
恐ろしいことに、これそれぞれのアウトカムごとに定義すれば良いというわけではなく、一つのアウトカムの中でも上記の幾つかを組み合わせねばならない場合が存在します。
たとえば、治療ラインなら初回処方は何か、併用療法は何か、そして処方継続はどうかといったことも全て考えねば定義できません。
めんどくさ笑。。。
終わりにその2
私は外資系企業と国立大学の疫学専門家として活動しておりますが、それ以前はブラック企業に勤める社畜として上司に怒鳴られる日々を送っていました。
「強く生きるには専門性だ」
そう一念発起し、大学院の修士課程に通い、そこから2年間で疫学専門家としてのキャリアにルートインし、2年で年収を1,400万アップさせることができました。
こちらのnoteでは、疫学の世界で活躍したいと考える方々に向けて、「専門性ゼロの段階からどうやって企業の疫学専門家のポジションをゲットするか」ということを解説します。
私自身が未経験から2年間で外資系企業の疫学専門家になるまでに積み重ねた経験、ノウハウの全てをお伝えするつもりで書き綴っています。
「これを読めば、企業の疫学専門家になるために必要な知識は全て揃う」
その気合いで、私のノウハウを全てお伝えします。
すきとほるからのお願い
本ブログは、読者の方が自由に記事の金額を決められるPay What You Want方式を採用しています。
学生さんや経済的に厳しい方からはお金を取りたくなく、それが経済格差に起因する学力格差へと繋がると考えるからです。
仕事の合間に記事を書く時間を見つけるのはちょっぴり大変ですが、今後も皆様の「研究生活をほんのり豊かに」できる記事をお届けし続けたいと思っております。
なのでお金に余裕があり、そして「勉強になった!」、「次も読みたい!」と本ブログに価値を感じてくださった場合は、以下のボタンをクリックし、ご自身が感じた価値に見合うだけの寄付を頂戴できますと幸いです。
励みになるので、ご寄付はとてもありがたいです!
引き続き情報発信していく活力になりますので、ぜひお気持ちに反しない範囲でご寄付をお願い致します!











