こんにちは、すきとほる疫学徒です。
ここ数年で注目を高めているリアルワールドデータ。
製薬企業のような環境におりますと、業界全体でリアルワールドデータへの期待値が高まっており、これまでリアルワールドデータとは無縁であった部署においても、「リアルワールドデータ」という用語が自然と飛び交うようになってきていることを感じます。
また製薬だけではなく、製薬を主たる顧客とするデータベース事業者さん、ヘルスケア系のコンサルさんにおいても同様にリアルワールドデータへの熱が高まっており、”製薬×疫学”という視点から情報収集していると、「リアルワールドデータ」という用語に出会わない日はないと言っても過言ではありません。
そんなリアルワールドデータですが、なぜここまで注目を集めているのでしょうか?
どうしてランダム化比較試験だけではいけないのでしょう?
リアルワールドデータに関心がある方の中には、しっかりと科学的な観点からリアルワールドデータの必要性を理解されている方もいれば、中には「最近流行っているから」とブームに駆り立てられている方もいらっしゃるかもしれません。
私としては、新たな研究の切り口としてリアルワールドデータへの関心が高まるのは素晴らしいことだと思うのですが、「なぜリアルワールドデータが必要なのか」ということを理解しておかないと、そのブームに駆り立てられるあまり、使うべきでない状況でリアルワールドデータを使ってしまったり、その魅力を十分に活かしきれなかったりと、リアルワールドデータのごように繋がる危険性があると思っております。
というわけで今回の記事では、一度初心に立ち返り、「なぜ僕たちにはリアルワールドデータが必要なのか」ということを一緒に勉強していきたいと思います。
・ランダム化比較試験と比べたリアルワールドデータの魅力
・リアルワールドデータを使う上で気を付けるべきこと
リアルワールドデータの定義
リアルワールドデータの必要性を解説する前に、まずはその定義をしっかりと確認しておきましょう。
FDAによる定義
アメリカの医薬品規制当局であるFDAは、リアルワールドデータを以下のように定義しています。
Real-world data are the data relating to patient health status and/or the delivery of health care routinely colleccted from a variety of sources. RWD can come from a number of sources, for example: Electronic health records, Claims and billing activities, Product and disease registries, Patient-generated data including in home-use settings, Data gathered from other sources that can inform on health status, such as mobile devices.
https://www.fda.gov/science-research/science-and-research-special-topics/real-world-evidence
ポイントとしては以下の2つですかね。
- 日常生活の中で集められる患者の健康や医療提供に関するデータであること
- 電子カルテや診療報酬請求だけでなく、患者報告データなど様々なデータソースが該当するということ
リアルワールドデータと聞くと、ついつい電子カルテデータや診療報酬請求データ、レジストリーなどの医療大規模データベースを想像してしまうかもしれませんが、日常生活の中で(リアルワールドで)集められたデータであれば、その規模感に関わらずリアルワールドデータに該当します。
リアルワールドデータの中にも、前者のようにSecondary data collection(診療行為など主目的のために集めたデータを、2次的に別の目的で使用する)による大規模なデータもあれば、後者のようにPrimary data collectionによる比較的小規模なデータもあるということは意識した方が良いでしょう。
現在日本で「リアルワールドデータ」という用語がブームのように使用される背後には、診療報酬請求データベースのような「医療大規模データ」のイメージが付随している印象ですが、”リアルワールドデータ=2次的医療大規模データ”という前提でリアルワールドデータを語ってしまうと、ミスリードに繋がりますので注意しましょう。
PMDAによる定義
さて、FDAと同じく医薬品規制当局であるPMDAではリアルワールドデータはどう定義されているでしょうか?
明確に定義している資料を見つけられなかったのですが、PMDAが定期的に発行している”最近の主な取組み状況”という資料の注釈にて、以下のように定義されていました。
リアルワールドデータとは、臨床試験とは異なり、実臨床の環境において収集された各種データを指す。
https://www.pmda.go.jp/files/000238165.pdf
実臨床で収集されたデータであること、様々なデータソースがあることはFDA定義と同じですが、PMDA定義ではあえて「臨床試験と異なり」と記載しているのが面白いですね。
これはリアルワールドデータというコンセプトが、元々は薬剤疫学において「RCTでは限界がある部分を、実臨床で集めたデータでカバーしよう」というモチベーションで発展してきたからです。
ですので、リアルワールドデータという用語の対岸には、ランダム化比較試験、ないしは臨床試験という用語が置かれているわけですね。
一方、薬剤開発のようにランダム化比較試験が必須ではない他分野の疫学では(社会疫学や環境疫学など)、 薬剤疫学ほどリアルワールドデータという用語は頻繁には用いられておりません。
これらの疫学分野ではコントロールされた臨床試験でデータを集めるということがそもそも頻繁に行われているわけではないので、あえて”実臨床で集められたデータ”であることを強調し、リアルワールドデータという用語を使う必要がないからだろうと私は考えております。
ISPOR(国際医薬経済・アウトカム研究学会)による定義
お次は、薬剤疫学に関する国際学会であるISPORの定義です。
We defined RW data as data used for decision-making that are not collected in conventional randomized controlled trials.
https://www.sciencedirect.com/science/article/pii/S1098301510604706
ポイントは、
- リアルワールドデータの対義語としてConventional RCTを置いている
ことです。
ISPORの論文では、リアルワールドデータのデータソースがいくつか紹介されていますが、その中に”Pracmatic clinical trial”が含まれております。
つまり、FDAやPMDAの定義では弾かれていた、臨床試験のデータもリアルワールドデータとしてカウントされているということですね。
Pragmatic CTとConventional CTは、どちらも前向きデータ収集であること、介入のランダム化をしうるという点では共通していますが、対象となる患者集団が異なります。
Conventional CTでは、患者集団の均一性を重視するために厳格な基準を満たした患者だけを内包しますが、Pragmatic CTでは、結果を実臨床に一般化させることを重視し、より広範な患者を内包します。
ISPORは患者集団の特性をベースにリアルワールドデータを定義しているのでしょう。
しかし、私個人としては国内外で”リアルワールドデータ”と言う際には、FDAやPMDAの定義のように、実臨床の中で集められたデータを指していることが殆どだと感じており、ISPORの定義は実際の使用感からズレます。
Wikipediaの定義
ついでですが、Chromeの検索画面に出ていたのでWikipediaの定義も覗いてみました。
そういえば学部時代に受けていた授業で、とある医学系領域のもの凄く偉くて世界的な実績のある先生が「レポートとか書くときに困ったら、Wikipediaを見ましょう。だいたい正しいです」と言っていたのを思い出します。
Real-world data refer to observational data as opposed to data gathered in an experimental setting such as a randomized controlled trial (RCT). They are derived from electronic health records (EHRs), claims and billing activities, product and disease registries, etc.
https://en.wikipedia.org/wiki/Real_world_data#cite_note-2
こちらもFDAやPMDAの定義同様に、臨床試験のようにコントロールされた状況を対岸に想定し、実臨床で集められた観察データをリアルワールドデータと定義していますね。
なぜリアルワールドデータが必要なのか
さて、これでリアルワールドデータの定義は確認できましたので、ここからはその必要性を説明していきましょう。
上で述べた通り、リアルワールドデータの対岸には、臨床試験で集められたデータがありますので、両者を比較しながら見ていくと、リアルワールドデータの必要性がよく分かると思います。
こちらはDr. Kimらが、「RWEはRCTに劣っているわけではなく、それぞれ強みと弱みがあるのだから、双方を活かしてエビデンスを形成していくべきである」という提言を行った論文からの引用です1。
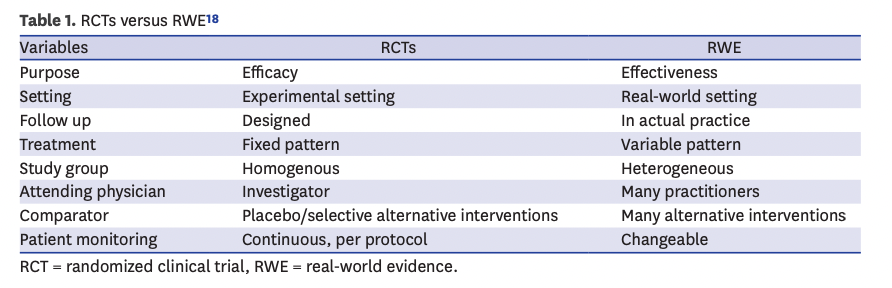
この表を念頭におきながら、ここからは項目ごとにRWDとRCTを比較していきましょう。
研究の対象となるコホートの違い
RCTとRWD研究とでは、研究の対象となるコホートがまるで違います。
薬剤の有効性を確認するための第3相臨床治験においては、非常に厳格な包含基準・除外基準を設けることで、比較的均質なコホートを形成することを目指すとともに、強い有害事象を被るリスクがある対象者は事前に除外します。
例えば、高齢者、小児、妊婦、腎機能の低下患者、何らかの基礎疾患を有する患者などですね。
一方、RWD研究は実臨床のプラクティスをベースにしたデータ収集を行うわけですので、RCTでは不適格として弾かれてしまった患者のデータも収集することができます。
理論上は、どのような患者であっても臨床の医師の判断で薬剤が投与され、それがデータとして記録されてさえいれば、コホートに含めることができるわけですね。
非常に厳しい適格基準を設定するRCTでは、上に述べたような有害事象のハイリスク患者における薬剤有効性・安全性は未知となってしまうことが多いですが、RWDを使うことができれば、そのようにRCTでは除外されてしまっていた患者に対しても、薬剤の有効性・安全性を確認することができます。
こちらの研究2ではリアルワールドデータにおける統合失調症の患者を対象に、RCTの適格基準を適用することで、どれだけの統合失調症患者が研究から除外されてしまうかを調べています。
図Aは、Finland・SwedenそれぞれのリアルワールドデータにRCTの除外基準を適応した際、該当した除外基準の数別に何%の患者が除外されたかを表しています。
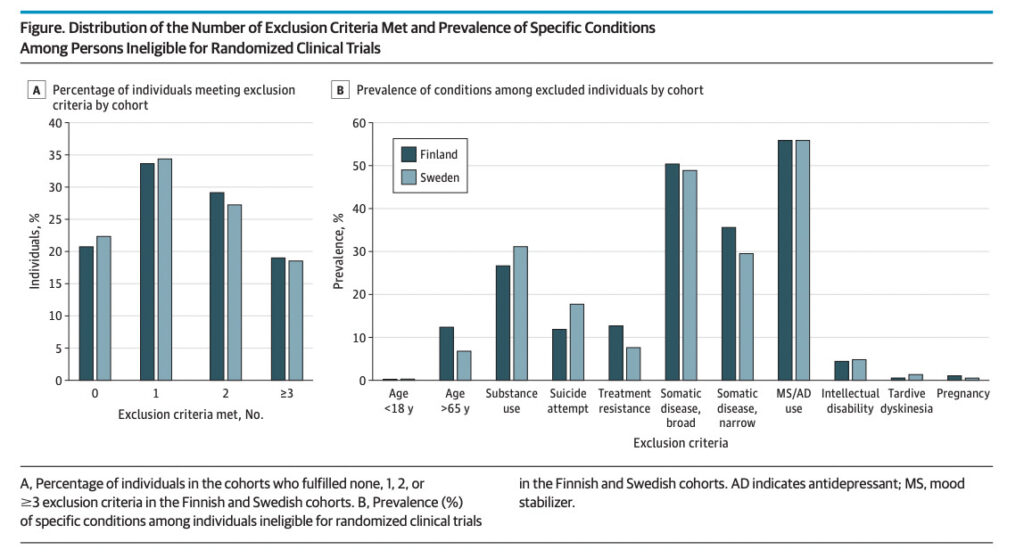
通常除外基準は一つでも該当すればコホートから除外となりますので、この場合は該当0の患者以外の約80%近くの統合失調症患者が、RCTでは除外されてしまうことになります。
また、図Bは該当した除外理由別の%を表しており、Soatic diseaseを有していた患者、Antdepressant/Mood stabilizerを使用していた患者が特に除外されていることが分かります。
このように、RCTの対象となったコホートと、実臨床でその薬剤に曝露しているコホートで、あまりにも特性に乖離がある場合には(そしてその特性が効果修飾因子である場合には)、ただ単純に「RCTの結果を、実際にその薬を使うすべての患者に外挿できる」というわけではなくなります。
これがリアルワールドデータが必要な理由の一つ目です。
追跡期間の違い
こちらの記事でも解説しましたが、有効性・安全性のアウトカムを対象とした研究をするには、そのアウトカムが発生するまでの期間を十分に追跡できるデータソースを使用せねばなりません。
こんにちは、すきとほる疫学徒です。 ここからしばらくは、薬剤疫学の曝露定義について一連の記事を書いていく予定です。 個人的には、2次的RWDを用いた薬剤疫学研究において、最も厄介なのがこの曝露定義だと思っています。 […]
しかしながら、RCTではこの患者の追跡期間が比較的短くなりがちです。
RCTの場合は莫大な予算を使い、患者をリクルートし、厳密な環境下で曝露の管理や観察を継続するわけですから、5年や10年と言った長期間にわたって患者を追跡することが難しいということは想像に難くありません。
かなり古いのですが、JAMAに掲載されたこちらの論文3では、RCTにおいて患者の包含スタートから論文出版まで中央値5.5年がかかっていると報告されています。
論文出版までで5.5年ですから、実際に患者を追跡できるのはそれより短く、3〜4年程度ではないでしょうか?
例えば薬剤性アレルギーのように超短期の追跡でも発見できるアウトカムを対象にするなら良いのですが、癌や骨折、心血管疾患のように比較的長期の誘導期間・潜在期間を有するアウトカムは、このように短期の追跡期間で拾い切るにはやや心もとないですよね。
一方、リアルワールドデータではRCTでは実現できない比較的長期の患者追跡が可能になる場合があります。
たとえば、保険者ベースの診療報酬請求データであれば、患者がその保険から脱退しない限りは理論上は追跡を継続することができます。
これにより、RCTの追跡期間では理論的には発生し得ないアウトカムに対しても研究を行うことができるわけですね。
なお、一口にリアルワールドデータといっても、保険者ベースの診療報酬請求データのように比較的長期間の患者追跡が可能なデータもあれば、病院ベースのデータや、患者報告データのように、そこまで長期間の患者追跡が難しいデータもありますので、”リアルワールドデータ=長期間の患者追跡可能”と認識してしまうと間違いですので、注意しましょう。
サンプルサイズの違い
追跡期間同様に、莫大な予算を使って行われるRCTにおいては、収集できるサンプルサイズにも限度があります。
また、薬剤に関するほとんどのRCTは、薬剤の安全性ではなく有効性をターゲットにしてサンプルサイズ計算をしているため、そもそも薬剤の安全性を十分に評価するだけのサンプルサイズを集めることを目指しておりません。
そのため、数万人から数十万人に一人のような希少疾患が有害事象として懸念されている場合も、RCTでは薬剤との因果関係はおろか、その発症頻度も測定できないという場合があります。
一方のRWD研究、特に診療報酬請求データや電子カルテデータなどの2次データを使えば、RCTとは比べ物にならない数の膨大なサンプルサイズを集めることができます。
これまで私が行なってきた研究に限っても、コホート定義によっては数十万から数百万という単位の患者データを使用したことがあり、リアルワールドデータの可能性の大きさに感銘を受けました。
そのようなリアルワールドデータの強みを活かした日本の研究が、こちらです。
この研究は、DPCデータを使用して麻酔後の悪性高熱症の発症頻度を調べたという比較的シンプルな研究なのですが、それでもAnesthesiologyというImpact Factor 約7.0というかなり良いJournalに掲載されています。
麻酔後の悪性高熱症は非常に発症頻度が低く、これまで十分な疫学データが蓄積されていなかったというのがその背景にあります。
このような状況下で、筆者らはDPCデータの124万人もの麻酔患者を対象にし、17件の悪性高熱症を拾い上げることに成功しました。
リアルワールドデータの数の理に着目した、素晴らしい研究だと思います。
もちろんサンプルサイズが多いからと言って、集団内の均質性や、データの欠損という観点からすべての患者を研究に使うことはできませんが、それでもRCTでは全く太刀打ちできなかった希少疾患をアウトカムに設定できるというのはリアルワールドデータの大きな強みです。
曝露の違い
RCTとRWD研究が「薬剤Aの曝露効果を見た」とする際、果たしてこれらの研究間で対象としている薬剤Aの曝露効果は同じものでしょうか?
いえ、その両者には大きな隔たりがあることが多いです。
RCTでは、薬剤Aへの曝露は事前に定められたプロトコールに則り、その量、タイミング、期間、飲み方などが厳密にコントロールされています。
そのようにして、RCTでは”理想的な”環境下で患者が薬剤Aに曝露し続けた際の、薬剤Aの曝露効果を見ているわけですね。
一方RWD研究においては、当然ながら薬剤Aへの曝露はコントロールのしようがありません。
リアルワールドデータは、実臨床の中で行われるリアルな事象をそのままデータにしておりますので、薬剤を処方する医師も、内服する患者も、従うべきプロトコールというのは何ら持ち合わせていないわけですね。
だからRCTと違い、リアルワールドデータでは薬の飲み忘れ、過剰・過小内服、さまざまな薬剤との併用など、本当に多種多様な”薬剤Aへの曝露”が測定されます。
これらは慎重に扱わなければ曝露の誤測定バイアスを起こす曲者である一方で、”より現実に即した使われ方をした際の、薬剤Aの曝露効果”を推定できるというメリットもあるわけですね。
比較群の違い
RCTにおいては、当然ながら事前に定めた比較群しか設定できません。
ですので、その結果は「事前に定めた比較群であるプラセボ群、もしくは特定の薬剤と比較した際の、薬剤Aの効果」として限定的な解釈をせざるを得なくなってしまいます。
一方のRWD研究においては、理論上はデータさえあればどのような薬剤であれ、比較群として設定することができます(比較可能性の話は置いておいて)。
よって、「RCTを行なった際には発売されていなかったが、最近発売された薬剤Bと比較して、薬剤Aの有効性・安全性はどうだろうか」といったクリニカルクエスチョンに対しても、リアルワールドデータを使えば柔軟に対応できるという強みがあります。
薬剤を扱う医師の違い
RCTでは一部の限られた医師のみが薬剤を処方し、その後のモニタリングに関与します。
RCTのような長期間、大規模な試験を実施できる施設というのは比較的大病院に限られますので、RCTの中で薬剤を扱う医師も、その病院で働いている医師がメインということになります。
一方、リアルワールドデータにおいては薬剤が保険収載されていれば、理論上はどの医療機関でも扱えるわけですので(処方に特別な条件を有する場合を除き)、その薬剤を扱う医師も、地域の診療所から都会の大学病院、研修医から高齢のベテラン医、その分野の専門医から他分野の医師までと、バライティーに富んでおります。
薬剤を扱う医師が違えば、処方プラクティスも、処方後の患者モニタリングのプラクティスも大きく変わりますので、その意味ではリアルワールドデータでの方が、より実際のプラクティスに即した薬剤Aの効果を推定することができるわけですね。
研究コストの違い
ここまでは研究デザインという観点からRCTとリアルワールドデータの違いをお伝えしてきましたが、ここからは費用や研究にかかる時間など、プロジェクトマネジメント的な観点からの違いをお伝えしていきたいと思います。
何度もお伝えしている通り、RCTには莫大な予算がかかります。
こちらの論文によれば5、レビュー対象となった16本のRCTでは、研究あたりのコストが20万ドル〜61,150万ドルであったことが報告されています。日本円でだいたい2,300万円〜700億くらいでしょうか。
1回3億のRCTだとしても、サラリーマンの生涯年収くらいの金額がたった1回の研究のために使われると思うと、何とも凄まじい世界です。。。
一方のリアルワールドデータ研究では、RCTほどコストをかけずに研究を行うことができます。
これはリアルワールドデータ研究の中でも、別の目的で集めたデータを2次的に利用する電子カルテデータベース、診療報酬請求データベースに言えることですね。
私自身も大学院生の時には、研究室が運営している医療大規模データを何ら費用を支払うことなく使用させて頂いておりましたが(もちろん学費は払っています)、今思えばとっても贅沢な環境でした。。。
じゃあお金を出してデータを買った場合には、リアルワールドデータの利用料はどれくらいなるのかというと、こちらがPMDAが運営するMID-NETと呼ばれる医療大規模データベースの利用料です。
製造販売後調査に使うとすると、1利活用につき約4,200万円ですね。
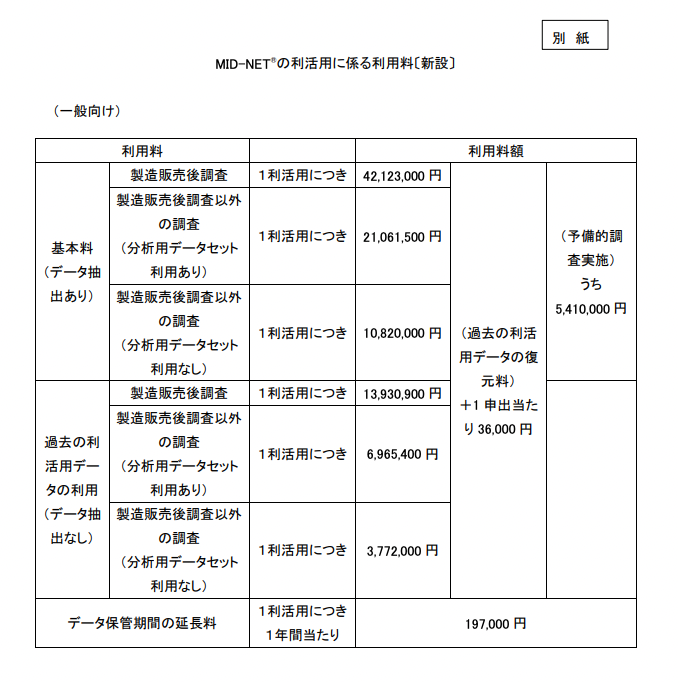
絶対値としてみると、「たっか!!!!」と思いますけれども、1本あたりうん億円のコストがかかるRCTと比較すれば、まだ目に入れることはできる数字かもしれません。
研究期間の違い
誤解される方もしらっしゃるかもしれませんので、最初に研究期間と追跡期間の違いを申し上げておきます。
研究期間:研究の開始から終了までにかかる時間
追跡期間:患者を追跡し続ける期間
一見すると、研究期間>追跡期間と思われるかもしれませんが、それは前向きに患者データの収集を行う場合のみです。
既に手元にある2次的データを使用して、後ろ向きに患者データの収集を行う際には、平均5年間の追跡期間を確保しながらも、研究開始から終了まで6ヶ月しかかからなかったということも実現できるわけですね。
この前提を踏まえて、RCTとRWD研究の違いをご説明させて頂きます。
先ほど紹介した論文で、RCTにおける患者の包含スタートから論文出版まで平均5.5年とお伝えしました。
RCTは当然ながら研究計画を立てたところから、よーいドンで前向きに患者の収拾を始めますので、十分な患者数が集まるまでの期間は研究を継続せざるを得ません。
一方、RWD研究の場合は、上で述べたように過去に蓄積されたデータを後ろ向きに用いることで、10年分の患者データを一瞬で入手できるといったことも実現可能なわけです(もちろん、それはその10年分のデータをコツコツと集め、クリーニングし、保管し続けてくださったデータ運営者の方がいるからに他なりません)。
研究は鮮度が命ということで、2次的RWD研究のように「このリサーチクエスチョンで研究するぞ!」と思い立てば、すぐ研究を実施、出版まで持っていけるというのはプロジェクトマネジメントの観点からは非常に魅力的でしょう。
私も修士課程の2年間で6本とそれなりの数の筆頭英語論文が書けたと思っておりますが(クオリティは置いておいて)、それもそれら全てが医療大規模データベースを利用した研究であったからに他なりません。
こうした医療大規模データベース研究における真の功労者というのは、データを集め、データベースを構築し、運営してくださっている方々ですので、私のようなポっと出の研究者にまで貴重なデータを使わせてくださる運営者の方々には深く感謝しております。
終わりに
さて、いかがでしたでしょうか?
RCTとリアルワールドデータの違いを説明してきました。
Efficacy-Effectiveness gapという言葉があるように、同じ薬剤・アウトカムを対象にした研究であっても、RCTのようなコントロールされた理想的な環境下で得られる結果(Efficacy)と、リアルワールドデータのような実世界で得られる結果(Effectiveness)にはGapがあることがあります。
その際、「RCTが疫学研究のゴールドスタンダードなんだから、RCTの結果の方が正しい」と断定してしまうのは危険です。
この記事で説明してきたように、そもそもRCTとRWDでは、対象としているコホート、曝露、アウトカム、追跡期間、薬剤の扱い方などが大きく異なっている可能性があり、その結果としてRCTとRWDで異なる研究結果が得られているかもしれません。
「RCT>RWD」と一概に決めることなく、着目しているリサーチクエスチョンに対してより正しく応えることができるのはRCTなのか、RWDなのかと考え、状況に応じて望ましい研究手法を選択すべきでしょう。
・「RCTが正しい」と短絡的に考えず、そのような違いを踏まえ、リサーチクエスチョンに適したデータソースを選ぶ必要がある
・RWDにはRCTにはない強みがある反面、研究にノイズが入りやすく、適切な研究デザインを用いなければ、強いバイアスがかかってしまう
なお、この記事では主に”リアルワールドデータ強み”にあてて解説をしてきましたが、リアルワールドデータはコントロールされない実臨床の世界のデータを利用できるという強みがある反面、その分、曝露定義やアウトカム定義にノイズが混じってしまい、慎重に研究デザインを組まなければ、強いバイアスの入った研究になってしまうという弱みもあります。
そのように私たちがリアルワールドデータを使用する際に気をつけるべき点は、こちらの姉妹記事でご説明しています。
こんにちは、すきとほる疫学徒です。 ここ数年で注目を高めているリアルワールドデータ。 昨日公開した記事では、「僕たちにリアルワールドデータが必要な8つの理由」として、RCTと比較しながら、リアルワールドデー[…]
すきとほる疫学徒からのお願い
本ブログは、読者の方が自由に記事の金額を決められるPay What You Want方式を採用しています。
「勉強になった!」、「次も読みたい!」と本ブログに価値を感じてくださった場合は、以下のボタンをクリックし、ご自身が感じた価値に見合うだけの寄付を頂戴できますと幸いです。
もちろん価値を感じなかった方、また学生さんなど金銭的に厳しい状況にある方からのご寄付は不要です。
引き続き情報発信していく活力になりますので、ぜひお気持ちに反しない範囲でご寄付をお願い致します!









